解题方法
1 . 如图所示,醇类物质在一种含 的配合物催化作用下可以转变成羧酸。下列说法错误的是
的配合物催化作用下可以转变成羧酸。下列说法错误的是
 的配合物催化作用下可以转变成羧酸。下列说法错误的是
的配合物催化作用下可以转变成羧酸。下列说法错误的是
| A.①→②,Rh元素被氧化 |
| B.增大催化剂的用量,甲醇的平衡转化率不变 |
C.CO作配体时,C原子的孤电子对与 的空轨道形成配位键 的空轨道形成配位键 |
| D.反应过程中③含量最少,其可能原因是③→④的反应活化能最大 |
您最近一年使用:0次
2024高三·全国·专题练习
2 . 工业合成氨常选择反应:N2+3H2 2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
 2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是| A.28 g N2完全反应,转移的电子数为3NA |
| B.混合气中物质的沸点:NH3>N2>H2 |
| C.在一定温度的固定容器中进行反应,通入氦气,能提高氢气的转化率 |
| D.反应物断裂NA个σ键的同时生成物断裂NA个σ键,反应达到平衡状态 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
3 . 烟气中的SO2可以在催化剂作用下被CH4还原为S:CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g),下列说法正确的是
| A.该反应的ΔS<0 |
B.该反应的平衡常数K=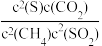 |
| C.反应每生成1molS,消耗22.4LSO2 |
| D.适当升高温度能提高催化剂的活性 |
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。通过氨热分解法制取氢气,其反应的化学方程式如下: 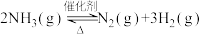
(1)根据下表数据,写出氨热分解法的热化学方程式___________ 。相关化学键的键能数据
(2)已知该反应的∆S=198.9×10-3kJ·mol-1·K-1,判断在300℃时反应是否能自发进行___________ (填“是”或“否”),理由是___________ 。
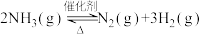
(1)根据下表数据,写出氨热分解法的热化学方程式
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
5 . 室温下,下列实验探究方案不能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向含酚酞的Na2CO3溶液中加入少量BaCl2固体,观察溶液颜色变化 | Na2CO3溶液中存在水解平衡 |
| B | 取久置Na2SO3粉末少许配成溶液,加入硝酸酸化,再加氯化钡溶液,观察现象 | 检验久置Na2SO3粉末变质 |
| C | 加热恒容密闭容器中NO2气体,观察气体颜色变化 | 2NO2(g) N2O4(g)是放热反应 N2O4(g)是放热反应 |
| D | 两支试管中分别盛相同温度、相同浓度、相同体积的H2O2溶液,分别滴加相同浓度、相同体积的FeCl3溶液与CuCl2溶液,滴加FeCl3溶液的试管中产生气体更快 | FeCl3对H2O2分解的催化效率更高 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024高三·全国·专题练习
6 . 以Cl2、SO2和PCl3为原料,制备POCl3和氯化亚砜(SOCl2)的原理为PCl3(g)+Cl2(g)+SO2(g) POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是
POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是
 POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是
POCl3(s)+SOCl2(g);ΔH<0,下列说法正确的是| A.使用催化剂可以同时降低正反应和逆反应的活化能 |
| B.1molCl-Cl键断裂的同时有2molS-Cl键形成,说明反应到达该条件下的平衡状态 |
C.反应平衡常数K= |
| D.上述反应中消耗3.36LCl2,转移电子数为0.3×6.02×1023 |
您最近一年使用:0次
2024高三·全国·专题练习
7 . H2S和CO2反应生成的羰基硫(COS)可用于粮食熏蒸,能防止某些昆虫、线虫和真菌的危害,反应热化学方程式为:CO2(g)+H2S(g) COS(g)+H2O(g);ΔH>0.下列说法正确的是
COS(g)+H2O(g);ΔH>0.下列说法正确的是
 COS(g)+H2O(g);ΔH>0.下列说法正确的是
COS(g)+H2O(g);ΔH>0.下列说法正确的是| A.上述反应中消耗34 g H2S,生成22.4 L水蒸气 |
B.上述反应的平衡常数K=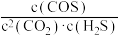 |
| C.已知该反应在加热条件下能自发进行,则其ΔS>0 |
| D.实际应用中,通过增加H2S的量来提高CO2的转化率,能有效减少碳排放 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
8 . CO2是一种常见的温室气体,也是巨大的碳资源。CO2可转化为CO、H2等燃料:CO2(g)+CH4(g)=2CO(g)+2H2(g);ΔH1=+247 kJ·mol-1。下列关于该反应的说法正确的是
| A.该反应在任何温度下都可自发进行 |
| B.反应CO2(s)+CH4(g)=2CO(g)+2H2(g);ΔH2<+247 kJ·mol-1 |
| C.反应中每生成1 mol H2,转移电子的数目为3×6.02×1023 |
| D.选择高效催化剂可以降低反应的焓变,提高化学反应速率 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
9 . Ⅰ.H2S与CH4重整,不但可以消除污染,还可以制氢。主要反应为 ;ΔH>0。
;ΔH>0。
(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应: ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。_______ 、_______ (填化学式)。
(3)M点对应温度下,H2S的转化率是_______ 。
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。_______ (填“A”“B”或“C”)组图像。三组图像中,C组图像中平均反应速率最低的可能原因是_______ 。
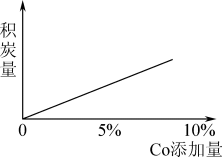
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为____ 。
 ;ΔH>0。
;ΔH>0。(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
| A.混合气体密度不变 |
| B.容器内压强不变 |
| C.2v正(H2S)=v逆(CS2) |
| D.CH4与H2的物质的量分数之比保持不变 |
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应:
 ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。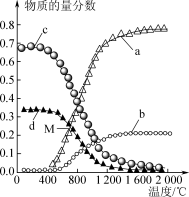
(3)M点对应温度下,H2S的转化率是
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。
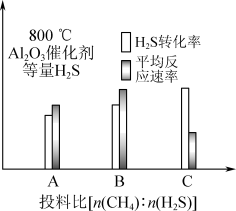
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
10 . 探究影响H2O2分解速率的影响因素,实验方案如图所示。
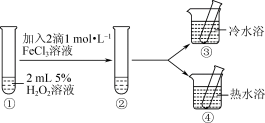
| A.热水浴的温度越高,其对比实验现象越明显 |
| B.H2O2易溶于水,主要是由于H2O2与H2O分子之间能形成氢键 |
| C.对比①②,可探究FeCl3溶液对H2O2分解速率的影响 |
| D.对比②③④,可探究温度对H2O2分解速率的影响 |
您最近一年使用:0次



