2024高三下·全国·专题练习
解题方法
1 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。通过氨热分解法制取氢气,其反应的化学方程式如下: 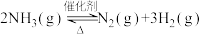
(1)根据下表数据,写出氨热分解法的热化学方程式___________ 。相关化学键的键能数据
(2)已知该反应的∆S=198.9×10-3kJ·mol-1·K-1,判断在300℃时反应是否能自发进行___________ (填“是”或“否”),理由是___________ 。
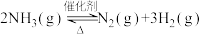
(1)根据下表数据,写出氨热分解法的热化学方程式
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
您最近一年使用:0次
名校
2 . 某化学小组选用酸性高锰酸钾溶液和草酸( )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
(1)实验原理的离子方程式:____________ 。
(2)实验2中的
______ ,目的是____________ 。
(3)根据上表中的实验数据,可以得到的结论是____________ 。
(4)利用实验1中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
______ mol/(L⋅min)。
 )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
a mol/L |
| 0.05 mol/L | 3 mol/L稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | v | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
(2)实验2中的

(3)根据上表中的实验数据,可以得到的结论是
(4)利用实验1中数据计算,用
 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
您最近一年使用:0次
2024-05-04更新
|
175次组卷
|
2卷引用:北京交大附中2023-2024学年高一下学期期中考试化学试题
2024高三下·全国·专题练习
解题方法
3 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。
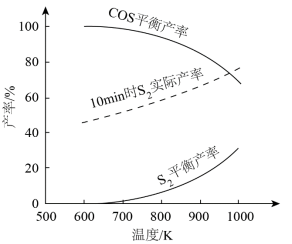
②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
您最近一年使用:0次
2024高三下·全国·专题练习
4 . 碳和氮的化合物在生产生活中广泛存在。低碳烃类(甲烷、乙烯、丙烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用。
一定条件下,碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应①: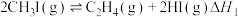
反应②: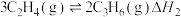
反应①和②在不同温度下的分压平衡常数 如下表,回答下列问题:
如下表,回答下列问题:
(1)根据表中数据推出反应①的活化能 (正)
(正)___________ (填“>”或“<”) (逆);
(逆);
(2)反应②的正、逆反应速率表达式有: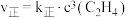 ,
,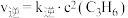 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: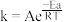 [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越___________ (填“大”或“小”)。当该反应达到平衡后,升高温度,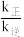 的值
的值___________ (填“增大”“减小”或“不变”);
一定条件下,碘甲烷
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应①:
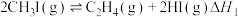
反应②:
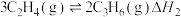
反应①和②在不同温度下的分压平衡常数
 如下表,回答下列问题:
如下表,回答下列问题: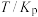 |  |  |  |  |  |  |
| 反应① | 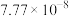 | 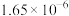 | 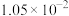 | 2.80 |  | 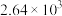 |
| 反应② | 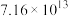 | 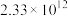 | 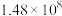 | 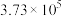 | 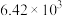 | 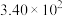 |
(1)根据表中数据推出反应①的活化能
 (正)
(正) (逆);
(逆);(2)反应②的正、逆反应速率表达式有:
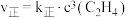 ,
,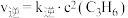 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: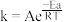 [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越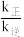 的值
的值
您最近一年使用:0次
2024高三下·全国·专题练习
5 . 将二氧化碳资源化是实现“碳中和”目标的重要手段。回答下列问题:
利用 和重整技术可获得合成气(主要成分为CO和
和重整技术可获得合成气(主要成分为CO和 ),反应如下:
),反应如下:
I: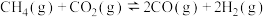

Ⅱ:
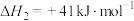
反应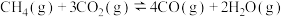 的
的
___________  ,该反应活化能
,该反应活化能 (正)
(正)___________  (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。
利用
 和重整技术可获得合成气(主要成分为CO和
和重整技术可获得合成气(主要成分为CO和 ),反应如下:
),反应如下:I:
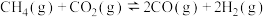

Ⅱ:

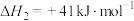
反应
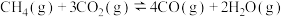 的
的
 ,该反应活化能
,该反应活化能 (正)
(正) (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
6 . 一定温度下,利用NH3催化还原NOx是目前应用广泛的烟气脱硝技术。一种以MnO2CeO2为催化剂处理NO的原理如图1所示。___________ 。
(2)该脱硝机理过程中的步骤Ⅰ可描述为___________ 。
(3)写出该脱硝过程中的化学方程式:___________ 。
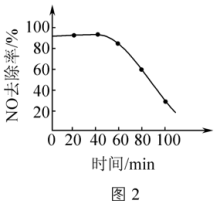
(4)为探究烟气中SO2的存在对脱硝性能的影响,在40min时向烟气中加入SO2,NO的去除率随时间变化如图2所示。试分析烟气中含有SO2导致NO去除率降低的原因:___________ 。
②MnO2分解为Mn2O3的最低理论温度是463℃。
结合催化剂脱硝机理,分析520~900℃范围内,催化剂重量开始增加的原因:___________ 。
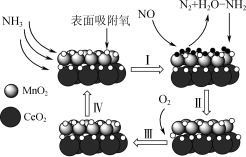 图1
图1
(2)该脱硝机理过程中的步骤Ⅰ可描述为
(3)写出该脱硝过程中的化学方程式:
(4)为探究烟气中SO2的存在对脱硝性能的影响,在40min时向烟气中加入SO2,NO的去除率随时间变化如图2所示。试分析烟气中含有SO2导致NO去除率降低的原因:
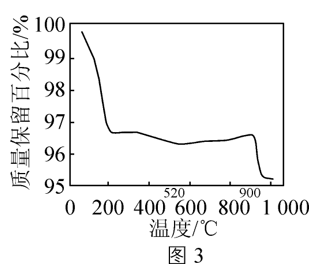
②MnO2分解为Mn2O3的最低理论温度是463℃。
结合催化剂脱硝机理,分析520~900℃范围内,催化剂重量开始增加的原因:
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
7 . 二甲醚是重要的有机合成原料,工业上常用合成气(主要成分为CO、H2)制备二甲醚,其主要反应如下。
反应ⅰ:CO(g)+2H2(g) CH3OH(g);
CH3OH(g);
反应ⅱ:2CH3OH(g) CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);
反应ⅲ:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=_______ (保留三位有效数字)。
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为_______ 。②需控制出气流量小于进气流量的原因为_______ 。
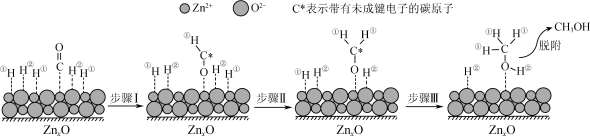
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。______________ 。
②在合成甲醇过程中,需要不断分离出甲醇的原因为_______ 。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g);
CH3OH(g);反应ⅱ:2CH3OH(g)
 CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);反应ⅲ:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
②在合成甲醇过程中,需要不断分离出甲醇的原因为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
8 . Ⅰ.H2S与CH4重整,不但可以消除污染,还可以制氢。主要反应为 ;ΔH>0。
;ΔH>0。
(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应: ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。_______ 、_______ (填化学式)。
(3)M点对应温度下,H2S的转化率是_______ 。
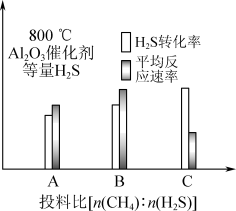
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。_______ (填“A”“B”或“C”)组图像。三组图像中,C组图像中平均反应速率最低的可能原因是_______ 。
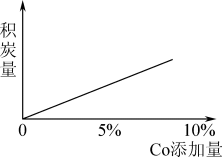
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为____ 。
 ;ΔH>0。
;ΔH>0。(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
| A.混合气体密度不变 |
| B.容器内压强不变 |
| C.2v正(H2S)=v逆(CS2) |
| D.CH4与H2的物质的量分数之比保持不变 |
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应:
 ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。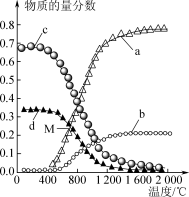
(3)M点对应温度下,H2S的转化率是
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
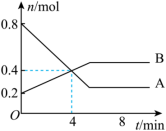
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
284次组卷
|
2卷引用:名校期中好题汇编-化学反应与能量(非选择题)
名校
解题方法
10 . I.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图: 时刻,正逆反应速率大小
时刻,正逆反应速率大小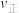
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(2)若 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率___________ 。
(3)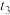 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为___________ 。
(4)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
(5)①本实验待测数据可以是___________ ,实验 和实验
和实验 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响﹔实验 和实验
和实验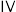 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响。
②实验发现 比实验
比实验 反应速率快,原因是
反应速率快,原因是___________ 。

 时刻,正逆反应速率大小
时刻,正逆反应速率大小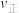
 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(2)若
 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率(3)
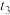 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为(4)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g |  硫酸溶液/mL 硫酸溶液/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
 | 2.0 | 50.0 | 25 | 0 | 0 |
 | 2.0 | 40.0 | 25 | 0 | 10.0 |
 | 2.0 | 50.0 | 25 | 0.2 | 0 |
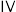 | 2.0 | 50.0 | 35 | 0 | 0 |
(5)①本实验待测数据可以是
 和实验
和实验 可以探究
可以探究 和实验
和实验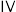 可以探究
可以探究②实验发现
 比实验
比实验 反应速率快,原因是
反应速率快,原因是
您最近一年使用:0次
2024-04-28更新
|
316次组卷
|
2卷引用:安徽省合肥市六校联盟2023-2024学年高一下学期4月期中考试化学试题




