解题方法
1 . 实验是科学探究的重要手段,下列实验操作或方案正确且能达到预期目的的是
| 选项 | A | B | C | D |
| 实验操作或方案 | 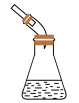 | 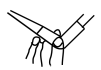 | 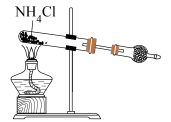 | 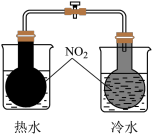 |
| 实验目的 | 石油分馏时接收馏出物 | 酸式滴定管排气操作 | 制取氨气 | 证明温度对平衡的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-26更新
|
1392次组卷
|
5卷引用:湖南省郴州市2024届高三上学期一模化学试题
湖南省郴州市2024届高三上学期一模化学试题(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)湖南省邵阳市绥宁县世贤中学2023-2024学年高三上学期12月月考化学试题(已下线)选择题6-10
名校
解题方法
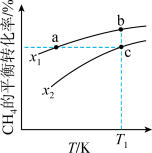
2 . 向一恒容密闭容器中加入1molCH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x(x=
CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x(x=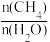 )随温度的变化曲线如图所示。下列说法错误的是
)随温度的变化曲线如图所示。下列说法错误的是
 CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x(x=
CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x(x=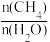 )随温度的变化曲线如图所示。下列说法错误的是
)随温度的变化曲线如图所示。下列说法错误的是
| A.x1<x2 |
| B.反应速率:Vb正<Vc正 |
| C.点a、b、c对应的平衡常数:Ka<Kb=Kc |
| D.a、b两点对应的平均相对分子质量大小:Ma>Mb |
您最近一年使用:0次
2023-10-26更新
|
476次组卷
|
3卷引用:广东省广州市铁一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
3 . 一定温度下,向3L的恒容密闭容器中(预先装入催化剂)通入2 mol N2和 3 mol H2,一段时间后,测得容器内压强是起始时的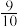 ,用H2表示的反应速率为0.1 mol/(L·min)。则这段时间为
,用H2表示的反应速率为0.1 mol/(L·min)。则这段时间为
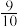 ,用H2表示的反应速率为0.1 mol/(L·min)。则这段时间为
,用H2表示的反应速率为0.1 mol/(L·min)。则这段时间为| A.2.5min | B.3.5min | C.4.5min | D.5.5min |
您最近一年使用:0次
2023-10-26更新
|
248次组卷
|
2卷引用:湖北省武汉市第四中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
4 . 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1molA、2molB,此时甲、乙的容积均为2L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:
 。达平衡时,乙的体积为2.6L,下列说法正确的是
。达平衡时,乙的体积为2.6L,下列说法正确的是


 。达平衡时,乙的体积为2.6L,下列说法正确的是
。达平衡时,乙的体积为2.6L,下列说法正确的是
| A.甲中反应的平衡常数小于乙 |
| B.若打开活塞K,达平衡时乙容器的体积大于3.2L |
| C.当乙中A与B的体积分数之比为1:2时,反应达到平衡状态 |
| D.平衡时甲容器中A的物质的量大于0.55mol |
您最近一年使用:0次
2023-10-25更新
|
355次组卷
|
3卷引用:课时3影响化学平衡的因素随堂练习
解题方法
5 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知在25℃和101kPa时存在下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H1=-3116kJ•mol-1
②C(石墨,s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ•mol-1
写出表示乙烷标准摩尔生成焓的热化学方程式_______ 。(标准摩尔生成焓是指在25℃和101kPa时,由元素最稳定的单质生成1mol纯化合物的焓变。)
(2)在一容积为2L的密闭容器中,CO和H2的初始物质的量均为0.3mol,在一定条件下发生反应:2CO(g)+2H2(g) CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
①由图可知,压强p3______ (填“>”或“<”)p1;压强为p2时,升高温度,反应的平衡常数将______ (填“增大”、“减小”或“不变”)。
②温度为1100℃、压强为p1时,x、y点:v正(x)______ (填“>”或“<”)v正(y);x点的平衡常数Kx为______ (Kx是指用平衡时各组分的物质的量百分数代替物质的量浓度计算得到的平衡常数)。
③在一定温度、p=160kPa的初始条件下,该反应达到平衡后体系的压强变为100kPa,则CO的平衡转化率为______ 。
④下列说法能说明该反应在上述条件下达到平衡状态的是______ (填字母)。
A.体系的密度不再发生变化
B.断裂2molH-H键的同时断裂2molC=O键
C.各组分的物质的量浓度不再改变
D.体系的气体的平均相对分子质量不再发生变化
E.体积分数:V%(CH4)=V%(CO2)
(3)固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,则b区发生的电极反应式为________ 。
(1)已知在25℃和101kPa时存在下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H1=-3116kJ•mol-1
②C(石墨,s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ•mol-1
写出表示乙烷标准摩尔生成焓的热化学方程式
(2)在一容积为2L的密闭容器中,CO和H2的初始物质的量均为0.3mol,在一定条件下发生反应:2CO(g)+2H2(g)
 CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
①由图可知,压强p3
②温度为1100℃、压强为p1时,x、y点:v正(x)
③在一定温度、p=160kPa的初始条件下,该反应达到平衡后体系的压强变为100kPa,则CO的平衡转化率为
④下列说法能说明该反应在上述条件下达到平衡状态的是
A.体系的密度不再发生变化
B.断裂2molH-H键的同时断裂2molC=O键
C.各组分的物质的量浓度不再改变
D.体系的气体的平均相对分子质量不再发生变化
E.体积分数:V%(CH4)=V%(CO2)
(3)固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,则b区发生的电极反应式为

您最近一年使用:0次
解题方法
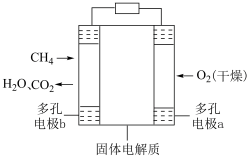
6 . 恒温恒容条件下,向密闭容器中加入一定量M,发生反应的方程式为①M N;②N
N;②N Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
 N;②N
N;②N Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
| A.反应过程中,随c(M)的减小,反应①、②的速率均降低 |
| B.温度高于T1时,总反应速率由反应①决定 |
| C.欲提高N的产率,需降低反应温度且控制反应时间 |
| D.体系中可能存在v(M)=v(N)+v(Q) |
您最近一年使用:0次
7 . 铬及其化合物在催化、金属防腐等方面具有重要应用。Cr2O3在丙烷脱氢过程中起到催化作用,其中的部分反应历程如图所示。下列说法错误的是
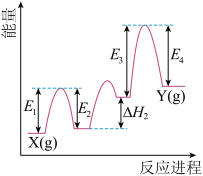

| A.反应中的最高能垒为E3 |
| B.该反应的焓变为E1-E2+△H2+E3-E4 |
| C.C3H8(g)=3C(石墨,s)+4H2(g),该反应在高温条件下不能自发进行 |
| D.Cr2O3在丙烷脱氢的反应过程中可能作氧化剂和氧化产物 |
您最近一年使用:0次
2023高三·全国·专题练习
8 . 丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):C3H8(g)=C3H6(g)+H2(g) ΔH1=+125 kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+ O2(g)=C3H6(g)+H2O(g) ΔH2=-118 kJ·mol-1
O2(g)=C3H6(g)+H2O(g) ΔH2=-118 kJ·mol-1
(1)对于反应Ⅰ,总压恒定为100 kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是_______ 。在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图a所示,计算T1时反应Ⅰ的平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数,保留一位小数)。

(2)在温度为T2时,通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2 s生成C3H6的平均速率为_______ kPa·s-1;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为_______ 。
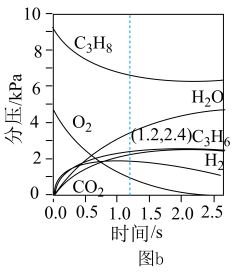
(3)恒温刚性密闭容器中通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合气体,已知某反应条件下只发生如下反应(k、k′为速率常数):
反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为_______ ,其理由是_______ 。
反应Ⅰ(直接脱氢):C3H8(g)=C3H6(g)+H2(g) ΔH1=+125 kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+
 O2(g)=C3H6(g)+H2O(g) ΔH2=-118 kJ·mol-1
O2(g)=C3H6(g)+H2O(g) ΔH2=-118 kJ·mol-1(1)对于反应Ⅰ,总压恒定为100 kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是

(2)在温度为T2时,通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2 s生成C3H6的平均速率为

(3)恒温刚性密闭容器中通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合气体,已知某反应条件下只发生如下反应(k、k′为速率常数):
反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为
您最近一年使用:0次
9 . 判断过程的自发性能确定过程能否一定发生和过程发生的速率。(____)
您最近一年使用:0次
2023高三·全国·专题练习
10 . 乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l)  CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·mol-1,已知纯物质和相关恒沸混合物的常压沸点如下表:
CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·mol-1,已知纯物质和相关恒沸混合物的常压沸点如下表:
请完成下列问题:
(1)关于该反应,下列说法不合理的是___________(填字母)。
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y=___________ ;若乙酸和乙醇的物质的量之比为n∶1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在如图中绘制x随n变化的示意图______ (计算时不计副反应)。
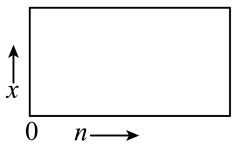
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和浓硫酸混合液加热至110 ℃左右发生酯化反应并回流,直到塔顶温度达到70~71 ℃,开始从塔顶出料。控制乙酸过量的作用有___________ 。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是___________(填字母)。
CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是___________(填字母)。

 CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·mol-1,已知纯物质和相关恒沸混合物的常压沸点如下表:
CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·mol-1,已知纯物质和相关恒沸混合物的常压沸点如下表:| 纯物质 | 沸点/℃ | 恒沸混合物 (质量分数) | 沸点/℃ |
| 乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
| 乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
| 乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08)+水(0.09) | 70.2 |
(1)关于该反应,下列说法不合理的是___________(填字母)。
| A.反应体系中硫酸有催化作用 |
| B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零 |
| C.因为反应的ΔH 接近于零,所以温度变化对平衡转化率的影响大 |
| D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计 |

(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和浓硫酸混合液加热至110 ℃左右发生酯化反应并回流,直到塔顶温度达到70~71 ℃,开始从塔顶出料。控制乙酸过量的作用有
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)
 CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是___________(填字母)。
CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是___________(填字母)。
| A.反应温度不宜超过300 ℃ |
| B.增大体系压强,有利于提高乙醇的平衡转化率 |
| C.在催化剂作用下,乙醛是反应历程中的中间产物 |
| D.提高催化剂的活性和选择性,减少乙醚、乙酸等副产物是工艺的关键 |
您最近一年使用:0次



