名校
1 . 请回答下列问题:
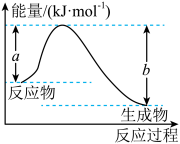
(1)如图表示某反应的能量变化关系,则此反应为___________ (填“吸热”或“放热”)反应,其中ΔH=___________ (用含有a、b的关系式表示)。___________ 114.6kJ(填“大于”、“等于”或“小于”)。
(3)在25℃,101kPa下,16g的N2H4(g)完全燃烧生成氮气和液态水时放热316kJ,则表示N2H4(g)燃烧热的热化学方程式为___________ 。
(4)甲醇(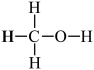 )既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g)
)既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=
CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=___________ 。
(1)如图表示某反应的能量变化关系,则此反应为
(3)在25℃,101kPa下,16g的N2H4(g)完全燃烧生成氮气和液态水时放热316kJ,则表示N2H4(g)燃烧热的热化学方程式为
(4)甲醇(
 )既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g)
)既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=
CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=
您最近一年使用:0次
2 . 热化学方程式是一种能够表明反应释放或吸收热量的热化学方程式。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=_____ 。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) ΔH=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g)=CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式_____ 。
(3)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ/mol、285.8kJ/mol和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_____ 。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) ΔH=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g)=CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式
(3)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ/mol、285.8kJ/mol和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式
您最近一年使用:0次
3 . 请根据学过的知识回答下列问题:
(1)
 完全燃烧生成液态水时放出341.7kJ热量,则表示
完全燃烧生成液态水时放出341.7kJ热量,则表示 燃烧热的热化学方程
燃烧热的热化学方程___________ 。
(2)已知: 键的键能是
键的键能是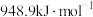 ,
, 键的键能是
键的键能是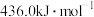 ,
, 键的键能是
键的键能是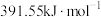 ,则
,则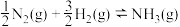

___________ 。
(3)已知:①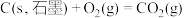
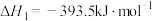
②

③

则298K时反应 的焓变:
的焓变:
___________ 。
(4)已知常温时红磷比白磷稳定,比较下列反应中 的大小:
的大小:
___________  。
。
①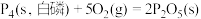

②

(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和
 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为___________ 。
(6)如图所示,某反应在不同条件下的反应历程分别为a、b。
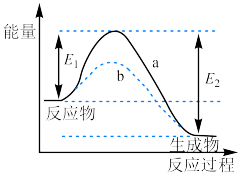
据图可判断出反应物的总键能___________ (填“>”“<”或“=”,下同)生成物的总键能,反应历程a、b的反应热___________ (填“相同”或“不相同”)。
(1)
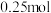
 完全燃烧生成液态水时放出341.7kJ热量,则表示
完全燃烧生成液态水时放出341.7kJ热量,则表示 燃烧热的热化学方程
燃烧热的热化学方程(2)已知:
 键的键能是
键的键能是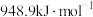 ,
, 键的键能是
键的键能是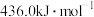 ,
, 键的键能是
键的键能是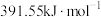 ,则
,则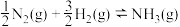

(3)已知:①
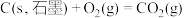
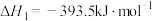
②


③


则298K时反应
 的焓变:
的焓变:
(4)已知常温时红磷比白磷稳定,比较下列反应中
 的大小:
的大小:
 。
。①
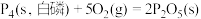

②


(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和

 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为(6)如图所示,某反应在不同条件下的反应历程分别为a、b。

据图可判断出反应物的总键能
您最近一年使用:0次
名校
4 . 氢能是一种极具发展潜力的清洁能源,目前有以下制取氢气的方法:
(1)水煤气变换制氢:

已知: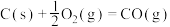
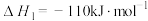
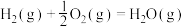
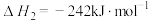


水煤气变换制氢体系中,一定时间内,CaO的添加情况与H2的体积分数关系如图。

①水煤气变换制氢反应的
_________ kJ·mol-1。
②添加CaO后H2的体积分数增大的原因是________ (用化学方程式表示)。
③纳米CaO和微米CaO相比,对应的H2体积分数更大的原因是:纳米CaO比微米CaO__________ 更大,从而与气体反应速率更快,相同时间内促进水煤气变换制氢反应正向进行的程度更大。
(2)甲醇水蒸气重整制氢: 。控制原料气
。控制原料气 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
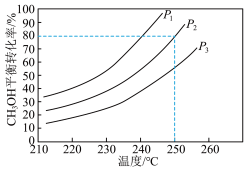
①甲醇水蒸气重整制氢反应在__________ 条件(填“高温”、“低温”或“任意温度”)下能自发进行。
②图中的压强由小到大的顺序是__________ ,理由是__________ 。
③温度为250℃、压强为 时,该反应的分压平衡常数
时,该反应的分压平衡常数
__________ (列出计算式,分压=总压×物质的量分数)。
(1)水煤气变换制氢:


已知:
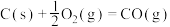
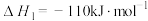
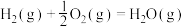
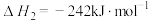


水煤气变换制氢体系中,一定时间内,CaO的添加情况与H2的体积分数关系如图。

①水煤气变换制氢反应的

②添加CaO后H2的体积分数增大的原因是
③纳米CaO和微米CaO相比,对应的H2体积分数更大的原因是:纳米CaO比微米CaO
(2)甲醇水蒸气重整制氢:
 。控制原料气
。控制原料气 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
①甲醇水蒸气重整制氢反应在
②图中的压强由小到大的顺序是
③温度为250℃、压强为
 时,该反应的分压平衡常数
时,该反应的分压平衡常数
您最近一年使用:0次
5 . 根据下列反应和信息回答下列问题:
在25℃和101 kPa条件下,H2+F2=2HF
已知:
(1)该反应中反应物断裂化学键需要吸收的能量E吸收=___________ kJ,生成物形成化学键放出的能量E放出=___________ kJ,该反应属于___________ 反应(填“放热”或“吸热”),放出(或吸收)___________ kJ的热量。
(2)该反应的能量变化图是___________
在25℃和101 kPa条件下,H2+F2=2HF
已知:
| 化学键 | H-H | F-F | H-F |
| 键能(/kJmol) | 436 | 157 | 568 |
(1)该反应中反应物断裂化学键需要吸收的能量E吸收=
(2)该反应的能量变化图是

您最近一年使用:0次
名校
解题方法
6 . 甲醇(CH3OH)广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=−71 kJ∙mol−1
②CO(g)+2H2(g)=CH3OH(l) ΔH=-90.5 kJ∙mol−1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=−890 kJ∙mol−1
(1)甲醇的燃烧热为__________ 。
(2)若CO的燃烧热为282.5 kJ∙mol−1,则H2的燃烧热为___________ 。
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=−71 kJ∙mol−1
②CO(g)+2H2(g)=CH3OH(l) ΔH=-90.5 kJ∙mol−1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=−890 kJ∙mol−1
(1)甲醇的燃烧热为
(2)若CO的燃烧热为282.5 kJ∙mol−1,则H2的燃烧热为
您最近一年使用:0次
名校
7 . 填空
(1)已知: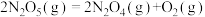
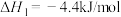

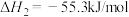
则反应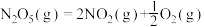

_______ kJ/mol。
(2)已知相关的化学键键能数据如下:
则

_______ kJ/mol。
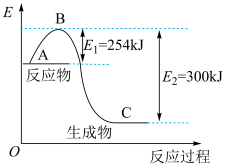
(3)下图是 和
和 反应生成
反应生成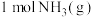 过程中能量变化示意图,合成氨反应的热化学方程式为
过程中能量变化示意图,合成氨反应的热化学方程式为_______ 。
(4)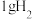 燃烧生成
燃烧生成 放热121 kJ,
放热121 kJ, 蒸发吸热44 kJ,
蒸发吸热44 kJ, 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(5)①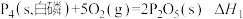
②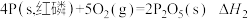
常温时红磷比白磷稳定,则
_______  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
(1)已知:
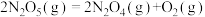
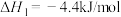

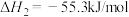
则反应
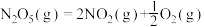

(2)已知相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | 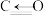 |
键能/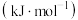 | 413 | 745 | 436 | 1075 |


(3)下图是
 和
和 反应生成
反应生成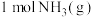 过程中能量变化示意图,合成氨反应的热化学方程式为
过程中能量变化示意图,合成氨反应的热化学方程式为
(4)
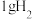 燃烧生成
燃烧生成 放热121 kJ,
放热121 kJ, 蒸发吸热44 kJ,
蒸发吸热44 kJ, 燃烧热的热化学方程式为
燃烧热的热化学方程式为(5)①
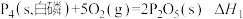
②
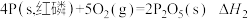
常温时红磷比白磷稳定,则

 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
您最近一年使用:0次
2024-01-12更新
|
324次组卷
|
2卷引用:海南省海口市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
8 . 把煤作为燃料可以通过下列两条途径来实现:
途径I: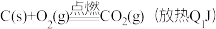
途径II:先制水煤气:
再燃烧水煤气: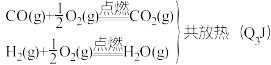
试回答下列问题:
(1)判断两条途径放出的热量的多少:途径I放出的热量___________ (填“大于”、“等于”、“小于”)途径II放出的热量。
(2) 的数学关系式是
的数学关系式是___________ 。
(3)由于制取水煤气的反应里,反应物所具有的总能量___________ 生成物所具有的总能量,因此在化学反应时,反应物需要___________ 能量才能转化为生成物,因此其反应条件为___________ 。
(4)简述煤通过途径II作为燃料的意义。___________
途径I:
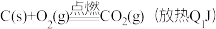
途径II:先制水煤气:

再燃烧水煤气:
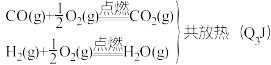
试回答下列问题:
(1)判断两条途径放出的热量的多少:途径I放出的热量
(2)
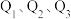 的数学关系式是
的数学关系式是(3)由于制取水煤气的反应里,反应物所具有的总能量
(4)简述煤通过途径II作为燃料的意义。
您最近一年使用:0次
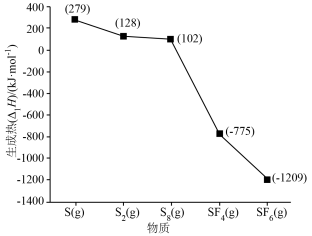
9 . 化学上,由稳定单质生成 纯物质的热效应称为生成热,稳定单质的生成热定为0。生成热的相对大小可以判断物质的相对能量。硫及其化合物的生成热如图所示。
纯物质的热效应称为生成热,稳定单质的生成热定为0。生成热的相对大小可以判断物质的相对能量。硫及其化合物的生成热如图所示。
回答下列问题:
(1)图中三种硫单质中,最稳定的是________ (填化学式,下同),最活泼的是__________ 。
(2)已知:i. ;
;
ii. ;
;
iii. 。
。
①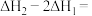
___________  。
。
②
___________ 0(填“>”“<”或“=”),判断依据是___________ 。
(3)根据图像,计算反应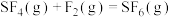 的
的
___________  。
。
 纯物质的热效应称为生成热,稳定单质的生成热定为0。生成热的相对大小可以判断物质的相对能量。硫及其化合物的生成热如图所示。
纯物质的热效应称为生成热,稳定单质的生成热定为0。生成热的相对大小可以判断物质的相对能量。硫及其化合物的生成热如图所示。
回答下列问题:
(1)图中三种硫单质中,最稳定的是
(2)已知:i.
 ;
;ii.
 ;
;iii.
 。
。①
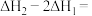
 。
。②

(3)根据图像,计算反应
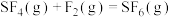 的
的
 。
。
您最近一年使用:0次
2023-12-01更新
|
55次组卷
|
2卷引用:海南省海南华侨中学 海南省农垦中学2023-2024学年高二上学期11月学业水平测试期中联考化学试题
10 . 20世纪初德国化学家哈伯(F.Haber)发明工业合成氨,人工制出氮肥,粮食产量显著提高,为解决人类温饱做出重大贡献。回答下列问题:
(1)合成氨的原料H2主要来源于煤的综合利用,如煤的气化: (吸热反应),煤的气化反应过程中能量变化可表示为
(吸热反应),煤的气化反应过程中能量变化可表示为_______ (填字母)。 纳米复合物)能以太阳光为能源,使水分解获得
纳米复合物)能以太阳光为能源,使水分解获得 ,其原理如图所示。反应①的化学方程式是
,其原理如图所示。反应①的化学方程式是_______ 。_______ (填“极性键”或“非极性键”,下同),形成的化学键是_______ 。
②生成17gNH3时,该反应_______ (填“吸收”或“放出”)的能量为_______ kJ。
(1)合成氨的原料H2主要来源于煤的综合利用,如煤的气化:
 (吸热反应),煤的气化反应过程中能量变化可表示为
(吸热反应),煤的气化反应过程中能量变化可表示为
 纳米复合物)能以太阳光为能源,使水分解获得
纳米复合物)能以太阳光为能源,使水分解获得 ,其原理如图所示。反应①的化学方程式是
,其原理如图所示。反应①的化学方程式是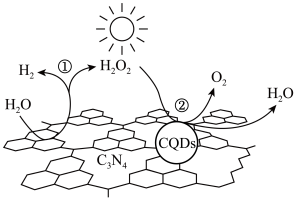
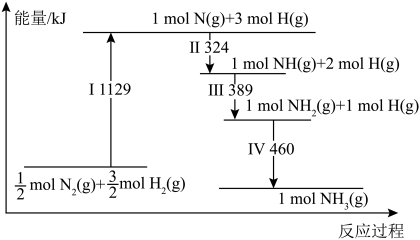
②生成17gNH3时,该反应
您最近一年使用:0次



