1 . 把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g);ΔH1=-393.15kJ·mol-1 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g) +H2(g);ΔH2 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3=-566kJ·mol-1 ③
2H2(g)+O2(g)=2H2O(g);ΔH4=-484kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_______ (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH2=______ 。
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减 少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,NO(g)+ O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________ 。
(4)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8kJ热量(298K),能表示其燃烧热的热化学方程式是________ ;已知断裂1mol下列化学键需要吸收的能量分别为:C=O:745kJ;O=O键:496kJ;C-H键:414kJ,则断裂1molH-O键需要吸收的能量为_______ 。
途径Ⅰ:C(s)+O2(g)=CO2(g);ΔH1=-393.15kJ·mol-1 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g) +H2(g);ΔH2 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3=-566kJ·mol-1 ③
2H2(g)+O2(g)=2H2O(g);ΔH4=-484kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上
(2)ΔH2=
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减 少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,NO(g)+
 O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=(4)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8kJ热量(298K),能表示其燃烧热的热化学方程式是
您最近一年使用:0次
2019-11-06更新
|
248次组卷
|
2卷引用:四川省邻水实验学校2019-2020学年高二上学期第一次月考化学试题
名校
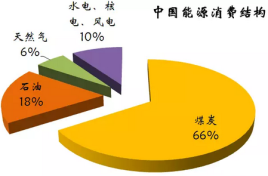
2 . 下图为我国目前的能源消费结构图:
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤炭为主,但直接燃烧煤炭的弊端是____ 。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:
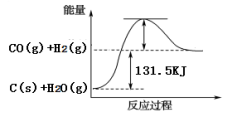
根据以上数据,写出该反应的热化学方程式_________________ ;
(3)甲醇是重要的化学工业基础原料和清洁液体燃料。将煤液化将克服直接将煤作为燃料的不足。其反应原理为CO2(g)+3H2(g) CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①在适当的催化剂作用下,该反应能自发进行。则该反应ΔH______ 0(填“>”、“<”或“=”)
②在体积一定的密闭容器中发生该反应,达到平衡后升高温度,下列说法正确的是______ 。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
③下列叙述能说明此反应达到平衡状态的是_______ 。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
④在相同起始温度(500℃)、起始体积相同(2L)的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
查阅资料发现500℃时该反应的平衡常数为2.5。则反应Ⅰ在10min时v正______ v逆,则反应均达到平衡时,反应Ⅰ、Ⅱ对比H2的百分含量关系w%Ⅰ(H2)______ w%Ⅱ(H2),反应Ⅰ、Ⅲ对比:平衡时CH3OH的浓度c(I)_______ c(Ⅲ)(本小题均用“>”、“<”或“=”填空)。
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤炭为主,但直接燃烧煤炭的弊端是
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:


根据以上数据,写出该反应的热化学方程式
(3)甲醇是重要的化学工业基础原料和清洁液体燃料。将煤液化将克服直接将煤作为燃料的不足。其反应原理为CO2(g)+3H2(g)
 CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。①在适当的催化剂作用下,该反应能自发进行。则该反应ΔH
②在体积一定的密闭容器中发生该反应,达到平衡后升高温度,下列说法正确的是
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
③下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
④在相同起始温度(500℃)、起始体积相同(2L)的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
| 反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
| 反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 10 min | 4.5 | ||||
| 反应Ⅱ:恒温恒压 | 0 min | 1 | 3 | 1 | 1 |
| 反应Ⅲ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
查阅资料发现500℃时该反应的平衡常数为2.5。则反应Ⅰ在10min时v正
您最近一年使用:0次
名校
解题方法
3 . 能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
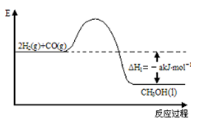
CO的燃烧热△H2=-b kJ/mol,CH3OH的燃烧热△H3=-c kJ/mol。请根据以上信息,回答下列有关问题:
(1)甲醇是一种______ (填“可”或“不可”)再生能源,甲醇的官能团的电子式是____________ 。
(2)CH3OH燃烧热的热化学反应方程式为___________________________________ 。
(3)H2的燃烧热△H=_______________________ 。
(4)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据算出b=_______ (用d、e、f的代数式表示)。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为
CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________ ,正反应放出的热量为__________________ ,CO的转化率为___________ 。
(6)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9kJ/mol,NO(g)+1/2O2(g)=NO2(g) ΔH=-58.2kJ/mol,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH=-241.6kJ/mol,反应3NO(g)+O3(g)==3NO2(g)的ΔH=________ kJ/mol。

CO的燃烧热△H2=-b kJ/mol,CH3OH的燃烧热△H3=-c kJ/mol。请根据以上信息,回答下列有关问题:
(1)甲醇是一种
(2)CH3OH燃烧热的热化学反应方程式为
(3)H2的燃烧热△H=
(4)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据算出b=
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为
CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为(6)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9kJ/mol,NO(g)+1/2O2(g)=NO2(g) ΔH=-58.2kJ/mol,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH=-241.6kJ/mol,反应3NO(g)+O3(g)==3NO2(g)的ΔH=
您最近一年使用:0次
4 . 氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为__________________________________ 。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,正极的电极反应式为__________________________________ 。

②如图装置中,某一铜电极的质量减轻3.2 g,则a极上消耗的O2在标准状况下的体积为____________ L
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),
2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),
反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是__________ 其中表示平衡混合物中NH3的含量最高的一段时间是_____
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应
后测得N2的转化率为50%。则反应的平衡常数为____________ 。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,正极的电极反应式为

②如图装置中,某一铜电极的质量减轻3.2 g,则a极上消耗的O2在标准状况下的体积为
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)
 2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),
2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应
后测得N2的转化率为50%。则反应的平衡常数为
您最近一年使用:0次
2016-12-09更新
|
413次组卷
|
4卷引用:四川省广安代市中学校2021-2022学年上学期高二第三次月考化学试题
5 . CO是合成尿素、甲酸的原料。
(1)在l00kPa和TK下,由稳定单质生成1mol化合物的焓变称为该物质在TK时的标准摩尔生成焓,用符号△H0表示。已知石墨和一氧化碳的燃烧热分别为393.5kJ/mol和283.0 kJ/mol,则CO(g)的△H0=________ 。
(2)合成尿素的反应:2NH3(g)+CO (g)=CO(NH2)2(g)+H2(g) △H = -81.0kJ/mol;T℃时,在体积为2L的恒容密闭容器中,将2 mol的NH3和1mol CO混合反应,5 min时,NH3的转化率为80%。则0—5min平均反应速率为v(CO)=_____________ 。

则:K1_________ 126.5(填“>”或“< ”);其判断理由是_________________ 。若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

① 若图中c表示平衡体系中尿素的体积分数,则a表示________ 的转化率。
②当 =
=____________ 时,尿素含量最大;此时,对于该反虚既能增大正反应速率又能使平衡正向移动的措施是______________ (写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。已知常温下,浓度均为0.1 mol/L的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka=___________ (已知lg2=0.3)。用电化学可消除H COOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
COOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
①Co3+氧化HCOOH的离子方程式为___________ ;
②忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”、“减小”或“不变”)。
(1)在l00kPa和TK下,由稳定单质生成1mol化合物的焓变称为该物质在TK时的标准摩尔生成焓,用符号△H0表示。已知石墨和一氧化碳的燃烧热分别为393.5kJ/mol和283.0 kJ/mol,则CO(g)的△H0=
(2)合成尿素的反应:2NH3(g)+CO (g)=CO(NH2)2(g)+H2(g) △H = -81.0kJ/mol;T℃时,在体积为2L的恒容密闭容器中,将2 mol的NH3和1mol CO混合反应,5 min时,NH3的转化率为80%。则0—5min平均反应速率为v(CO)=

则:K1

① 若图中c表示平衡体系中尿素的体积分数,则a表示
②当
 =
=(3)通过人工光合作用可将CO转化成HCOOH。已知常温下,浓度均为0.1 mol/L的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka=
 COOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
COOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。①Co3+氧化HCOOH的离子方程式为
②忽略体积变化,电解前后Co2+的浓度将
您最近一年使用:0次



