名校
1 . 完成下列问题。
(1)在 时,
时, 在足量的氧气中充分燃烧生成二氧化硫,放出
在足量的氧气中充分燃烧生成二氧化硫,放出 的热量,则表示S的燃烧热的热化学方程式为
的热量,则表示S的燃烧热的热化学方程式为___________ 。
(2)现有反应: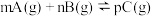 ,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
①该反应的逆反应为___________ 热反应,且
___________ p(填“>”、“=”或“<”)。
②减压时,A的质量分数___________ 。(填“增大”、“减小”或“不变”,下同)
③若加入B(体积不变),则A的转化率___________ 。
④若升高温度,则平衡时B、C的浓度之比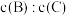 将
将___________ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量___________ 。
⑥若B是有色物质,A、C均无色,则加入C(体积不变)后混合物颜色___________ ;(填“变深”、“变浅”或“不变”,下同)维持容器内压强不变,充入氖气后,混合物颜色___________ 。
(3)已知相同条件下
反应I:
反应Ⅱ:
则反应
___________ 。(用 表示)。
表示)。
(1)在
 时,
时, 在足量的氧气中充分燃烧生成二氧化硫,放出
在足量的氧气中充分燃烧生成二氧化硫,放出 的热量,则表示S的燃烧热的热化学方程式为
的热量,则表示S的燃烧热的热化学方程式为(2)现有反应:
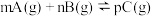 ,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:①该反应的逆反应为

②减压时,A的质量分数
③若加入B(体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比
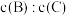 将
将⑤若加入催化剂,平衡时气体混合物的总物质的量
⑥若B是有色物质,A、C均无色,则加入C(体积不变)后混合物颜色
(3)已知相同条件下
反应I:

反应Ⅱ:

则反应

 表示)。
表示)。
您最近一年使用:0次
名校
解题方法
2 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
则途径I放出的热量___________ (填“大于”“等于”或“小于”)途径II放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___________ 。
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式___________ 。
(3)已知①CO(g)+ O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=___________ 。
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:___________
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
则途径I放出的热量
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式
(3)已知①CO(g)+
 O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol②H2(g)+ O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:
您最近一年使用:0次
2021-10-15更新
|
194次组卷
|
2卷引用:广东省梅州市梅江区梅州中学2021-2022学年高二上学期阶段性考试化学试题
名校
3 . 按要求完成下列问题。
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为_______ 。
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成 会放出
会放出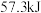 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:_______ 。
(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)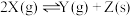
(乙)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是_______ ;能表明(乙)达到化学平衡状态是_______ 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成
 会放出
会放出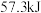 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)
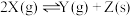
(乙)

当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
您最近一年使用:0次
2021-09-22更新
|
306次组卷
|
2卷引用:广东省珠海市第二中学2022-2023学年高二上学期10月月考化学试题
名校
4 . 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH = -196.6 kJ/mol。请回答下列问题:
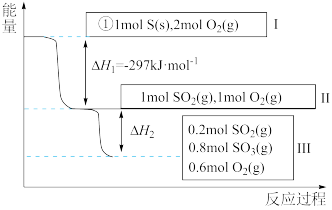
(1)写出能表示硫的燃烧热的热化学方程式:____ 。
(2)状态Ⅱ到状态Ⅲ放出的热量为____ 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣______ (填“大”、“小”或“相等”)。
(4)反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数表达式______ ;若状态Ⅲ处于平衡状态,保持温度不变,将容器体积迅速增大到原来2倍,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
(5)恒容条件下,在状态Ⅱ时采取下列措施,能使n(SO3)/ n(SO2)增大的有___ 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______ ;图中表示平衡混合物中SO3的含量最高的一段时间是______ 。


(1)写出能表示硫的燃烧热的热化学方程式:
(2)状态Ⅱ到状态Ⅲ放出的热量为
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣
(4)反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数表达式
(5)恒容条件下,在状态Ⅱ时采取下列措施,能使n(SO3)/ n(SO2)增大的有
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是

您最近一年使用:0次
5 . 下表是一些烷烃的燃烧热,则下列表达正确的是
| 化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 异戊烷 | 3531.3 |
| A.正戊烷的燃烧热大于3531.3 kJ·mol-1 |
| B.相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多 |
C.正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g)  CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1 CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1 |
D.甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)  CO2(g) +2H2O(g) △H =-891.0kJ·mol-1 CO2(g) +2H2O(g) △H =-891.0kJ·mol-1 |
您最近一年使用:0次
2017-08-29更新
|
145次组卷
|
5卷引用:广东省深圳市第七高级中学2020-2021学年高二上学期第一学段考试化学试题
6 . (1)以CO2为碳源制取低碳有机物成为国际研究焦点,下面CO2加氢制取低碳醇的热化学方程式:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJ•mol﹣1
则2CH3OH(g)=CH3CH2OH(g)+H2O(g) 的反应热△H=_________
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式_________
(3)在一定温度下,有c(H+)相同盐酸、硫酸、醋酸三种酸,物质的量浓度分别为c1、c2、c3,则三者由大到小的顺序是_________
(4)对于A+2B(g)⇌nC(g)在一定条件下达到平衡后,增大压强,平衡不移动,若n=2,A的状态为_______ ;若A为固体,增大压强,C的组分含量减少,则n_________
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJ•mol﹣1
则2CH3OH(g)=CH3CH2OH(g)+H2O(g) 的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式
(3)在一定温度下,有c(H+)相同盐酸、硫酸、醋酸三种酸,物质的量浓度分别为c1、c2、c3,则三者由大到小的顺序是
(4)对于A+2B(g)⇌nC(g)在一定条件下达到平衡后,增大压强,平衡不移动,若n=2,A的状态为
您最近一年使用:0次



