1 . 为了更好的解决能源问题,人们在研究如何提高燃料燃烧效率的同时,也在寻找新能源。下列说法不正确的是
| A.太阳能、地热能、核聚变能均属于新能源 |
| B.为了使燃料充分燃烧,通入的空气越多越好 |
| C.通过洁净煤技术及烟气脱硫,减轻燃煤污染,并提高煤燃烧的热利用率 |
| D.为开发氢能,可设法将太阳能聚焦,产生高温使水分解产生氢气 |
您最近半年使用:0次
名校
解题方法
2 . 结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压条件下测定)
| 选项 | 已知条件 | 热化学方程式 |
| A |  的燃烧热数值为a kJ/mol 的燃烧热数值为a kJ/mol | 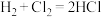 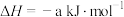 |
| B | 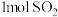 与足量 与足量 充分反应后,放出热量 充分反应后,放出热量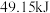 |  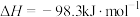 |
| C |   | 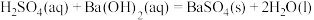 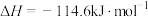 |
| D | 31g白磷比31g红磷能量多b kJ |  , ,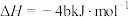 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-12-19更新
|
243次组卷
|
8卷引用:作业(二) 热化学方程式 燃烧热
18-19高一下·江苏·期中
名校
解题方法
3 .  是一种火箭燃料。已知在25℃、101 kPa下,
是一种火箭燃料。已知在25℃、101 kPa下,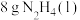 完全燃烧生成氮气和液态水时放出133.5 kJ热量。则下列热化学方程中正确的是
完全燃烧生成氮气和液态水时放出133.5 kJ热量。则下列热化学方程中正确的是
A.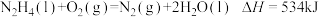 |
B.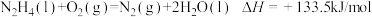 |
C.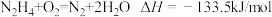 |
D.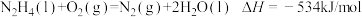 |
您最近半年使用:0次
2023-12-14更新
|
108次组卷
|
16卷引用:第一节 化学反应与能量的变化(第1课时 焓变 反应热)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)
(已下线)第一节 化学反应与能量的变化(第1课时 焓变 反应热)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.1 化学反应的焓变-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省沭阳县2018-2019学年高一下学期期中调研测试化学试题江苏省宿迁市宿豫中学2019-2020学年高一下学期四月调研试(奥赛班)化学试题山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题江苏省徐州市睢宁县古邳中学2019-2020学年高一下学期期中调研考试化学试卷江苏省盐城市大丰区新丰中学2019-2020学年高一下学期期中考试化学试题河南省平顶山市鲁山县第一高级中学2019-2020学年高一6月月考化学试题黑龙江省大庆市第十中学2020-2021学年高二上学期开学考试化学试题黑龙江省绥化市明水县第一中学2020-2021学年高二上学期第一次月考化学试题黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题黑龙江省佳木斯市建三江第一中学2021-2022学年高一下学期期末测试化学试题江苏省徐州市2022-2023学年高一下学期期中考试化学试题江苏省扬州中学2022-2023学年高一下学期3月月考化学试题海南省海口市第一中学2023-2024学年高二上学期11月期中考试化学试题江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷
2018高三上·全国·专题练习
名校
解题方法
4 . 下列关于热化学方程式的说法正确的是
A.若 的燃烧热为a kJ⋅mol 的燃烧热为a kJ⋅mol ,则热化学方程式为 ,则热化学方程式为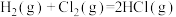  kJ⋅mol kJ⋅mol |
B.若1 mol  和0.5 mol 和0.5 mol  完全反应放热98.3 kJ,则热化学方程式为 完全反应放热98.3 kJ,则热化学方程式为  kJ⋅mol kJ⋅mol |
C.若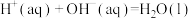 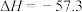 kJ⋅mol kJ⋅mol ,则稀硫酸与稀 ,则稀硫酸与稀 反应的热化学方程式为 反应的热化学方程式为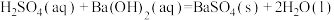  kJ⋅mol kJ⋅mol |
D.若3l g白磷的能量比3l g红磷多b kJ,则白磷转化为红磷的热化学方程式为 (白磷,s) (白磷,s) (红磷,s) (红磷,s)  kJ⋅mol kJ⋅mol |
您最近半年使用:0次
2023-10-12更新
|
309次组卷
|
65卷引用:1.1.2 热化学方程式 燃烧热(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)
(已下线)1.1.2 热化学方程式 燃烧热(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)第一节 反应热 第2课时 热化学方程式 燃烧热(已下线)2018年9月10日 《每日一题》一轮复习-热化学方程式的书写(已下线)2018年12月20日 《每日一题》人教选修4-热化学方程式的书写与判断百所名校联考-化学反应与能量(已下线)2019年9月9日《每日一题》2020年一轮复习—— 热化学方程式的书写(已下线)考点08 化学反应中的能量变化——《备战2020年高考精选考点专项突破题集》宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题黑龙江省牡丹江市第一高级中学2020-2021学年高二上学期8月开学考试化学试题(已下线)第一章 化学反应的热效应(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)辽宁省盘锦市第二高级中学2020-2021学年高二上学期第一次阶段性考试化学试题山东省济宁市实验中学2020-2021学年高二上学期10月月考化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷A卷化学试题福建省武平县第一中学2021-2022学年高二上学期10月月考化学试题重庆市重庆实验外国语学校2021-2022学年高二上学期9月月考化学试题江苏省泰州中学2021-2022学年高二上学期第一次月度检测化学试题(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练安徽省合肥市第六中学2021-2022学年高二上学期月考化学试题福建省泉州现代中学2021-2022学年高二上学期9月月考化学试题山东省济钢高级中学2021-2022学年高二上学期第二次教学检测化学试题山东省济南市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点01 化学反应与能量-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)湖北省部分省级示范高中2021-2022学年高二上学期期中测试化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)北京理工大学附属中学2021-2022学年高二上学期期中练习化学试题黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题广东省广雅中学2021-2022学年高二上学期期中考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题辽宁省丹东市东港第二高级中学2021-2022学年高二上学期11月第二次教学检测化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)宁夏永宁县永宁中学2021-2022学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2022-2023学年高二上学期开学考试化学试题 (已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省红安县第一中学2022-2023学年高二上学期9月考试化学试题湖北省襄阳市第五中学2022-2023学年高二上学期9月化学试题山东省青岛第二中学2022-2023学年高二上学期10月月考化学试题安徽省舒城中学2022-2023学年高二上学期第二次月考化学试题重庆市永川北山中学校2022-2023学年高三上学期期中质量监测化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高二上学期期中考试化学试题福建省石狮市第一中学2022-2023学年高二上学期第一次月考化学试题甘肃省兰州市第二中学2022-2023学年高二上学期期中考试化学试题广东省广州市育才中学2022-2023学年高二上学期期中考试化学试题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)专题15 反应热计算的几种类型-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)黑龙江省双鸭山市第一中学2022-2023学年高二下学期开学考试化学试题湖南省长沙市芙蓉高级中学2022-2023学年高二上学期期中考试化学试题广东省广州市从化区从化中学2022-2023学年高二上学期期中考试化学试题(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题广东省广州真光中学2021-2022学年高二上学期期中考试化学试题(已下线)专题突破卷07 化学反应与能量?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题四川省成都外国语学校2023-2024学年高二上学期10月月考化学试题福建省福州市连江尚德中学2023-2024学年高二上学期第一次诊断性测试化学试题广东省梅州市大埔县虎山中学2023-2024学年高二上学期10月期中考试化学试题四川省成都市成华区某校2023-2024学年高一上学期期中考试化学试题陕西省西安中学2023-2024学年高三上学期实验班11月练考理科综合能力测试题
解题方法
5 . 以甲烷为原料制取氢气是工业上常用的制氢方法。已知有关化学反应的能量变化如图所示:
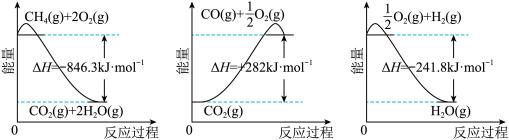
(1)下列说法正确的是___________(填字母)。
(2)CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________ 。

(1)下列说法正确的是___________(填字母)。
| A.CH4的摩尔燃烧焓为846.3 kJ·mol-1 |
| B.CO的摩尔燃烧焓为282 kJ·mol-1 |
| C.H2的摩尔燃烧焓为241.8 kJ·mol-1 |
| D.CO(g)+H2O(g)=CO2(g)+H2(g)为放热反应 |
您最近半年使用:0次
6 . 已知:①CH4(g)的摩尔燃烧焓为890.3 kJ/mol;②1 mol CH4(g)不完全燃烧生成CO(g)和H2O(l)时,放出519 kJ热量。若1 mol CH4(g)在m g O2(g)中燃烧生成CO(g)、CO2(g)和H2O(l),放出704.65 kJ热量。
(1)写出表示CH4(g)摩尔燃烧焓的热化学方程式。________
(2)写出CH4(g)不完全燃烧的热化学方程式。________
(3)计算CH4(g)完全燃烧和不完全燃烧的物质的量之比及m的值。_____
(1)写出表示CH4(g)摩尔燃烧焓的热化学方程式。
(2)写出CH4(g)不完全燃烧的热化学方程式。
(3)计算CH4(g)完全燃烧和不完全燃烧的物质的量之比及m的值。
您最近半年使用:0次
7 . 已知丙烷的摩尔燃烧焓ΔH=-2215kJ·mol-1。试计算丙烷完全燃烧生成1.8g水时放出的热量。_____
您最近半年使用:0次
8 . 已知1 g丁烷(C4H10)完全燃烧生成二氧化碳和液态水时,放出50 kJ的热量。
(1)请写出丁烷燃烧的热化学方程式_______ 。
(2)计算10 kg丁烷完全燃烧生成二氧化碳和液态水时放出的热量_______ 。
(1)请写出丁烷燃烧的热化学方程式
(2)计算10 kg丁烷完全燃烧生成二氧化碳和液态水时放出的热量
您最近半年使用:0次
9 . 在25 ℃、101 kPa时,已知葡萄糖的摩尔燃烧焓是2 800 kJ/mol,当它氧化生成1 g水时放出的热量是
| A.26.0 kJ | B.51.9 kJ | C.155.8 kJ | D.467.3 kJ |
您最近半年使用:0次
9-10高二下·浙江温州·期末
名校
解题方法
10 . 在25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的摩尔燃烧焓依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+ O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6 kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) ΔH=-1 400 kJ/mol |
您最近半年使用:0次
2023-08-26更新
|
1315次组卷
|
53卷引用:1.2 燃烧热 能源(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)
(已下线)1.2 燃烧热 能源(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第二节 燃烧热 能源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.2 热化学方程式 燃烧热-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)1.1.2 热化学方程式 燃烧热(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)1.1.2 热化学方程式 燃烧热(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)第3课时 反应焓变的计算(已下线)09-10年温州市高二下学期期末四校联考化学卷(已下线)2010年河北省邯郸市高二上学期期末考试化学试卷(已下线)2010—2011学年湖北省长阳一中高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期末考试化学试卷(已下线)2011-2012学年江西上饶中学高一零点、实验班下期末化学试卷(已下线)2013届陕西省宝鸡市高三第三次模拟理综化学试卷(已下线)2013-2014学年海南省三亚市一中高二上学期期中考试理科化学试卷(已下线)2013-2014学年海南三亚一中高二上学期期中考试理科化学试卷(B)(已下线)2014届高考化学二轮复习提分训练 专题5化学反应与能量练习卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷2014-2015四川省邛崃市高埂中学高二下学期第一次月考化学试卷2015-2016学年贵州省思南中学高二上第一半月考化学试卷2016届贵州省遵义航天高级中学高三第五次模拟理科综合试卷2016届海南省华侨中学高三考前模拟理综化学试卷2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷2016-2017学年吉林省汪清六中高二上第一次月考化学试卷2016-2017学年广西柳州铁路一中高二上段考理化学卷辽宁省鞍山市第一中学2016-2017学年高一下学期期中考试化学试题宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题1山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题2山西省忻州二中2018-2019学年高二上学期期中考试化学试题(已下线)2019年9月1日《每日一题》人教选修4—— 每周一测河南省周口中英文学校2019-2020学年高二上学期第一次月考化学试题四川省广安市岳池县顾县中学2019—2020学年第一学期高二上学期期中测试化学(选修四)试题山西省运城市景胜中学2019-2020学年高二上学期期中考试化学试题江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中联考(自主班)化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题内蒙古自治区通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二上学期期中考试化学试题河南省豫北名校2020-2021学年高二上学期11月质量检测化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题江苏省南菁高级中学2020-2021学年度高二上学期第一次阶段性考试化学(强化班)试题江苏省江阴长泾中学2020~2021学年下学期期中考试化学试题青海省海东市第二中学2020-2021学年高二4月月考化学试题吉林省长春外国语学校2020-2021学年高一下学期期末考试化学试题(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练甘肃省舟曲县第一中学2021-2022学年高二上学期第一次月考化学试题江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期期中考试化学试题山西省运城市康杰中学2021-2022学年高二上学期期中化学试题(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第02讲 热化学方程式与燃烧热(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)云南省昆明市寻甸县第二中学2022-2023学年高二上学期10月月考 化学试卷(已下线)单项选择题(已下线)专题01 反应热、焓变与热化学方程式【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)



