名校
解题方法
1 . 近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g) ⇌H2O(g) +CO(g) ΔH1 = + 41.1 kJ•mol-1
CO(g)+2H2(g) ⇌CH3OH(g) ΔH2=-90.0 kJ•mol-1
写出CO2催化氢化合成甲醇的热化学方程式:___________________________________________ 。
(2)为提高CH3OH产率,理论上应采用的条件是_______ (填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
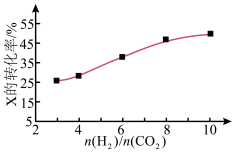
反应物X是_______ (填“CO2”或“H2”)。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
①化学平衡常数K =_______ 。
②催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
根据上表所给数据,用CO2生产甲醇的最优选项为_______ (填字母)。
(1)已知:CO2(g)+H2(g) ⇌H2O(g) +CO(g) ΔH1 = + 41.1 kJ•mol-1
CO(g)+2H2(g) ⇌CH3OH(g) ΔH2=-90.0 kJ•mol-1
写出CO2催化氢化合成甲醇的热化学方程式:
(2)为提高CH3OH产率,理论上应采用的条件是
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

反应物X是
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
①化学平衡常数K =
②催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
| 实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为
您最近一年使用:0次
2019-12-19更新
|
553次组卷
|
3卷引用:鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
2014·全国·一模
名校
解题方法
2 . 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________ 。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
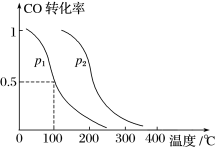
①p1________ p2(填“大于”、“小于”或“等于”);
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________ (填“增大”、“减小”或“不变”),平衡常数_____ (填“增大”、“减小”或“不变”)。
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________ (填“已经”或“没有”)达到平衡,此时刻υ正 ______ υ逆 (填“>”、“<”或“=”)。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。

①p1
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应
您最近一年使用:0次
2019-11-24更新
|
726次组卷
|
5卷引用:章末检测卷(二)化学反应的方向、限度与速率
2016高二·全国·课时练习
解题方法
3 . 请根据下面所给出的5个热化学方程式,判断反应④的反应热_______。
①NH3(g)+HCl(g)===NH4Cl(s)ΔH1=-176kJ·mol-1
②NH3(g)+H2O(l)===NH3·H2O(aq)ΔH2=-35.1kJ·mol-1
③HCl(g)+H2O(l)===HCl(aq)ΔH3=-72.3kJ·mol-1
④NH4Cl(s)+H2O(l)===NH4Cl(aq)ΔH4=?
⑤NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l)ΔH5=-52.3kJ·mol-1
①NH3(g)+HCl(g)===NH4Cl(s)ΔH1=-176kJ·mol-1
②NH3(g)+H2O(l)===NH3·H2O(aq)ΔH2=-35.1kJ·mol-1
③HCl(g)+H2O(l)===HCl(aq)ΔH3=-72.3kJ·mol-1
④NH4Cl(s)+H2O(l)===NH4Cl(aq)ΔH4=?
⑤NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l)ΔH5=-52.3kJ·mol-1
您最近一年使用:0次
名校
解题方法
4 . 已知:碳的燃烧热ΔH1=akJ·mol-1;
S(s)+2K(s)=K2S(s)ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s);ΔH3=ckJ·mol-1
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)ΔH=xkJ·mol-1。则x为
S(s)+2K(s)=K2S(s)ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s);ΔH3=ckJ·mol-1
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)ΔH=xkJ·mol-1。则x为
| A.3a+b-c | B.c+3a-b | C.a+b-c | D.c+a-b |
您最近一年使用:0次
2016-10-31更新
|
473次组卷
|
3卷引用:人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 课时1 盖斯定律
11-12高二上·福建泉州·期中
解题方法
5 . 将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。 已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1=_____________ 。
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1=
您最近一年使用:0次



