1 . 某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
①H2(g)+ O2(g)=H2O(g) ΔH=-242kJ•mol-1
O2(g)=H2O(g) ΔH=-242kJ•mol-1
②H2(g)+S(g)=H2S(g) ΔH=-20kJ•mol-1
③H2(g)+Se(g)⇌H2Se(g) ΔH=+81kJ•mol-1
④H2O(g)=H2O(l) ∆H=-44kJ/mol
请回答:
(1)上述反应中属于放热反应的是_______ (填序号,下同),属于吸热反应的是_______ 。
(2)2gH2完全燃烧生成气态水,放出的热量为_______ 。
(3)请写出O2与H2S反应生成S的热化学方程式_______ 。
(4)根据下图写出热化学方程式_______ 。
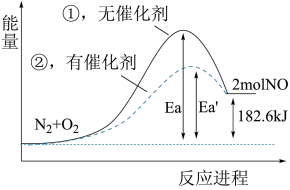
(5)加入催化剂该反应的反应热∆H是否发生了改变_______ (填“是”或“否”)。
(6)请写出H2燃烧热的热化学方程式_______ 。
①H2(g)+
 O2(g)=H2O(g) ΔH=-242kJ•mol-1
O2(g)=H2O(g) ΔH=-242kJ•mol-1②H2(g)+S(g)=H2S(g) ΔH=-20kJ•mol-1
③H2(g)+Se(g)⇌H2Se(g) ΔH=+81kJ•mol-1
④H2O(g)=H2O(l) ∆H=-44kJ/mol
请回答:
(1)上述反应中属于放热反应的是
(2)2gH2完全燃烧生成气态水,放出的热量为
(3)请写出O2与H2S反应生成S的热化学方程式
(4)根据下图写出热化学方程式

(5)加入催化剂该反应的反应热∆H是否发生了改变
(6)请写出H2燃烧热的热化学方程式
您最近一年使用:0次
2 . 下列与化学反应能量变化相关的叙述中,正确的是
| A.热化学方程式的ΔH大小与化学计量数无关 |
| B.利用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C.H2(g)的燃烧热ΔH=-285.8kJ·mol-1,则反应2H2O(g)=2H2(g)+O2(g)的反应热ΔH=+571.6kJ·mol-1 |
| D.测定中和反应反应热的时候,测量盐酸和NaOH混合溶液刚开始的温度,记为反应前体系的温度 |
您最近一年使用:0次
名校
解题方法
3 . (1)①已知:
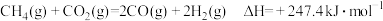
则 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为_______ 。
(2)一定条件下,在水溶液中所含离子 、
、 、
、 、
、 、
、 各
各 ,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应
,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应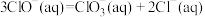 的
的
_______  。
。
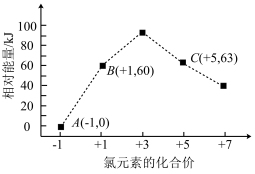
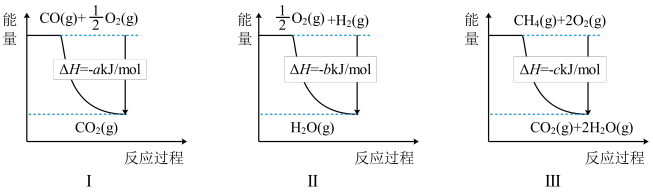
(3)工业上可通过天然气跟水蒸气反应制取 :
: ,有关反应的能量变化如下图所示,则该反应的
,有关反应的能量变化如下图所示,则该反应的
_______  (用含
(用含 、
、 、c的式子表示)。
、c的式子表示)。

则
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)一定条件下,在水溶液中所含离子
 、
、 、
、 、
、 、
、 各
各 ,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应
,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应 的
的
 。
。
(3)工业上可通过天然气跟水蒸气反应制取
 :
: ,有关反应的能量变化如下图所示,则该反应的
,有关反应的能量变化如下图所示,则该反应的
 (用含
(用含 、
、 、c的式子表示)。
、c的式子表示)。
您最近一年使用:0次
名校
4 . 已知:①

②

③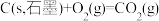

④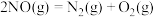

下列关系正确的是
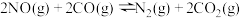

②


③
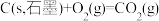

④
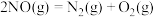

下列关系正确的是
A. |
B. |
C.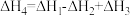 |
D.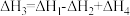 |
您最近一年使用:0次
2021-06-25更新
|
644次组卷
|
4卷引用:四川省成都市蓉城名校联盟2020-2021学年高一下学期期末联考化学试题
四川省成都市蓉城名校联盟2020-2021学年高一下学期期末联考化学试题西藏自治区拉萨中学2020-2021学年高一下学期期末考试化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)第03讲 盖斯定律(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
5 . 在25℃、1.01×105Pa下,将22gCO2通入750mL1mol/LNaOH溶液中充分反应,测得反应放出ykJ的热量。已知在该条件下,1molCO2通入1L2mol/LNaOH溶液中充分反应放出xkJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
A.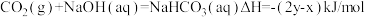 |
B.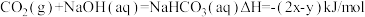 |
C.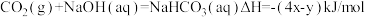 |
D. |
您最近一年使用:0次
2021-06-22更新
|
504次组卷
|
7卷引用:内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题
内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高一下学期期中考试化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)第1章 化学反应的热效应(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)广东省揭阳市惠来慈云实验中学2021-2022学年高二上学期第一次月考化学试题河北省石家庄实验中学2021-2022学年高二上学期10月月考化学试题2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】
6 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸等。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
表中a为___________ 。
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
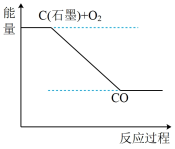
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为___________ 。
②根据反应I、II、III,下列说法正确的是___________ (填选项字母)。
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol| N-H | H-H | N≡N | |
| 断开1 mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为
②根据反应I、II、III,下列说法正确的是
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
您最近一年使用:0次
7 . 下列与化学反应能量变化相关的叙述正确的是
| A.ΔH﹥0表示放热反应,ΔH﹤0表示吸热反应 |
| B.热化学方程式的化学计量数可以表示分子数或原子数,因此必须是整数 |
| C.根据盖斯定律,可计算某些难以直接测量的反应热 |
| D.同温同压下,H2( g)+Cl2(g)=2HCl (g),在光照和点燃条件的△H不同 |
您最近一年使用:0次
名校
8 . 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,旧键断裂,新键形成必然有能量变化。已知拆开1molH-H键、1molI-I、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘反应生成1molHI需要___________ (填“放出”或“吸收”)___________ kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。在如图甲、乙两装置中,甲中负极电极反应式为___________ ,溶液中的阴离子向___________ 极移动(填“Zn”或“Pt”);乙中铜电极作负极,发生___________ 反应(填“氧化”或“还原”)。
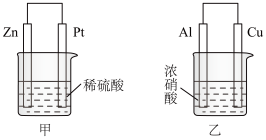
(1)从能量的角度看,旧键断裂,新键形成必然有能量变化。已知拆开1molH-H键、1molI-I、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘反应生成1molHI需要
(2)在生产和生活中经常遇到化学能与电能的相互转化。在如图甲、乙两装置中,甲中负极电极反应式为

您最近一年使用:0次
名校
解题方法
9 . 工业合成氨的反应N2+3H2⇌2NH3的能量变化如图所示,请回答有关问题:
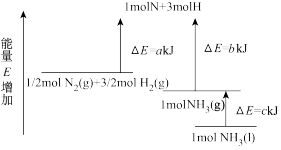
(1)合成1molNH3(l)____ (填“吸收”或“放出”)____ kJ的热量。
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)___ (填“吸收”或“放出”)的热量___ (填“多”或“少”)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是__ (填“黑磷”或“红磷”)。
(4)某实验小组同学对电化学原理进行了一系列探究活动。
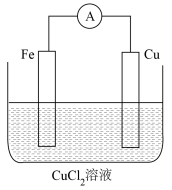
该电池基于总反应____ (用离子方程式表示)来设计的,一段时间后,铜极质量变化32g,则导线中通过____ mol电子。

(1)合成1molNH3(l)
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)某实验小组同学对电化学原理进行了一系列探究活动。

该电池基于总反应
您最近一年使用:0次
名校
10 . 证据推理与模型认知是化学学科的核心素养之一。下列事实与相应定律或原理相符的
| A.常温常压下,1体积乙醇完全燃烧消耗3体积O2——阿伏加德罗定律 |
| B.向漂白液中加入少量稀硫酸能增强漂白液的漂白效果——元素周期律 |
| C.通过测量C、CO的燃烧热来间接计算2C(s)+O2(g)=2CO(g)的反应热——盖斯定律 |
| D.体积可变的密闭容器中加入等体积的H2和I2(g)发生反应,加压体系颜色加深——勒夏特列原理 |
您最近一年使用:0次
2021-04-29更新
|
360次组卷
|
3卷引用:衔接点20 物质的量在化学实验中的应用-2021年初升高化学无忧衔接
(已下线)衔接点20 物质的量在化学实验中的应用-2021年初升高化学无忧衔接广东省汕头市第一中学2020-2021学年高二上学期期末考试化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题



