1 . 已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A原子最外层电子数是次外层电子数的2倍,C是地壳中含量最多的元素,D是短周期原子半径最大的元素,E原子最外层电子数与C原子最外层电子数相等。回答下列问题:
(1)C元素在周期表中的位置是______________ 。
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因_______ 。
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是________ 。
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是_________ 。
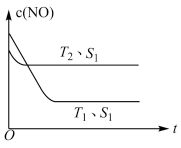
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H____ 0 (填“>”或“<”)。
(6)实验室制取F的单质时,常含有少量HCl气体,可用_________ (试剂)除去HCl,请用平衡移动的原理解释原因:________ 。
(1)C元素在周期表中的位置是
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H

(6)实验室制取F的单质时,常含有少量HCl气体,可用
您最近一年使用:0次
名校
2 . 某废水中含有的NH 在一定条件下可被O2氧化,反应过程如下:
在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kJ/mol
②NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kJ/mol
下列叙述不正确 的是
 在一定条件下可被O2氧化,反应过程如下:
在一定条件下可被O2氧化,反应过程如下:①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kJ/mol
②NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kJ/mol
下列叙述
| A.1mol的NH3和1mol 的NH4+都有10×6.02×1023个电子 |
| B.室温下,0.1 mol/L HNO2溶液pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH= -346kJ/mol |
| D.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
您最近一年使用:0次
2017-06-02更新
|
628次组卷
|
3卷引用:北京市石景山区精华学校2019-2020学年高三上学期二次月考化学试题



