1 . 已知: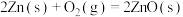
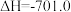 kJ·mol-1
kJ·mol-1

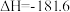 kJ·mol-1
kJ·mol-1
则反应 的
的 为
为
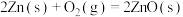
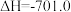 kJ·mol-1
kJ·mol-1
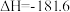 kJ·mol-1
kJ·mol-1则反应
 的
的 为
为| A.+519.4kJ⋅mol-1 | B.-259.7kJ⋅mol-1 | C.+259.7kJ⋅mol-1 | D.-519.4kJ⋅mol-1 |
您最近一年使用:0次
2024-02-07更新
|
351次组卷
|
90卷引用:北京市首都师范大学附属中学2023-2024学年高二上学期9月检测化学试题
北京市首都师范大学附属中学2023-2024学年高二上学期9月检测化学试题(已下线)2012届山东省济宁一中高三上学期第二次定时练习化学试卷(已下线)2012-2013学年江苏省如皋中学高二10月阶段练习化学试卷(已下线)2012-2013学年陕西省三原县北城中学高二第四次月考化学试卷(已下线)2013届广东省佛山一中高三第二次段考化学试卷(已下线)2015届吉林省汪清县第六中学高三第三次月考化学试卷2014-2015学年内蒙古巴市一中高二10月月考化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2016届福建省三明一中高三上学期第二次月考化学试卷2015-2016学年四川省南充市老林中学高二上学期9月月考化学试卷2017届山东省枣庄三中高三上学期9月质检化学试卷2016-2017学年贵州省湄潭县湄江中学高二上第一次月考化学试卷2016-2017学年河南省南阳市宛东五校高二上第一次联考化学试卷2017届河北邯郸市大名一中高三上学期第二次月考化学试卷2016-2017学年安徽省合肥一中高二上月考一化学试卷2017届福建省柘荣一中、宁德中学高三上联考一化学卷宁夏育才中学2017-2018学年高二9月月考化学试题山东省垦利第一中学2017-2018学年高二上学期第一次月考化学试题河北省邢台第三中学2017-2018学年高二9月月考化学试题【全国百强校】福建省上杭县第一中学2018-2019学年高二上学期10月月考化学试题福建省福州市长乐高级中学2019-2020学年高二上学期第一次月考化学(学考)试题福建省福州市长乐高级中学2019-2020学年高二上学期第一次月考化学(选考)试题河南省周口中英文学校2019-2020学年高二上学期第一次月考化学试题河南省郑州市106中学2019-2020学年高二9月月考化学(理)试题云南省曲靖市会泽县茚旺高级中学2020届高三上学期11月月考化学试题安徽省涡阳县第一中学2019-2020学年高二12月月考化学试题辽宁省凌源市第三中学2019-2020学年高二下学期第一次月考化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下期第二次月考化学试题广东省揭阳市揭西县河婆中学2020-2021学年高二上学期第一次月考化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题四川省峨眉第二中学校2021-2022学年高二下学期5月月考化学试题四川省广安第二中学校2021-2022学年高二上学期第一次月考化学试题北京市顺义区第一中学2022-2023学年高二上学期10月月考化学试题辽宁省阜新市第二高级中学2022-2023学年高二上学期9月月考化学试题北京市和平街第一中学2023-2024学年高二上学期10月阶段性练习化学试题云南省宣威市第三中学2023-2024学年高二上学期第四次月考化学试题山东省菏泽市外国语学校2023-2024学年高二上学期化学10月份月考试题(已下线)2011-2012学年黑龙江省牡丹江一中高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省杭州十四中高二上学期期末化学试卷(已下线)2011-2012学年天津一中高二上学期期中考试化学试卷(已下线)2012届陕西省兴平市秦岭中学高三上学期期末练习化学试卷(已下线)2011-2012学年浙江省嘉兴一中高一下学期期中考试化学试卷(已下线)2011-2012学年天津市天津一中高二上学期期中考试化学试卷(已下线)2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(已下线)2013-2014学年天津市红桥区高二上学期期末考试化学试卷(已下线)2014陕西省西安中学高三上学期第三次质量检测化学试卷(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷(已下线)2014秋安徽省宿州市高二上学期期中化学(理)试卷2014-2015学年黑龙江省伊春市伊春二中高二上学期期中化学试卷2014-2015学年云南省景洪市第四中学高二下学期期中考试化学试卷2015-2016学年福建省宁德市霞浦七中高二上期中(理)化学试卷2015-2016学年山东省淄博市淄川一中等三校高二上期末联考化学试卷2015-2016学年河北省沧州一中高一下期末化学试卷2015-2016学年福建省福州市文博中学高二上期中化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题湖北省武汉市武昌区2017_2018学年高二化学上学期期中化学试题黑龙江省哈尔滨市第三中学2017-2018届高二上学期模块考试(期末)化学试题安徽省滁州市(九校)2017-2018学年高二上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2017-2018学年高一下学期期末考试(理)化学试题人教版高二化学选修四专题:化学反应热的计算同步练习卷【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题福建省莆田市第八中学2018-2019学年高二(理)上学期期中考试化学试题北京四中2018-2019学年高一下学期期末考试化学试题海南省海口市第四中学2020届高三上学期摸底考试化学试题甘肃省永昌四中2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业一 化学反应中的能量变化西藏自治区日喀则市南木林高级中学2019-2020学年高二上学期期中化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期末考试化学试题河南省周口市扶沟县包屯高中2019---2020学年高二上期期末考试化学试题甘肃省张掖市高台县第一中学2018-2019学年高二上学期期末考试理科化学试题(已下线)1.3.2 反应热的计算(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)山东省滕州市第一中学2020-2021学年高二9月开学收心考试化学试题四川省成都市蓉城高中教育联盟2019-2020学年高二上学期期中联考化学试题福建省漳州市平和县第一中学2021届高三上学期期中考试化学试题吉林油田第十一中学2020-2021学年高二上学期期中考试化学试题四川省达州市宣汉县第二中学2020-2021学年高二上学期期中考试理综化学试题广东省江门市第二中学2020-2021学年高二上学期第二次考试(期中)化学试题河北省张家口市宣化一中2020-2021学年高二上学期期末考试化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期中考试化学试题2011年普通高等学校招生全国统一考试化学(海南卷)海南省鑫源中学2021-2022学年高二上学期期中考试化学试题新疆喀什第二中学2022-2023学年高二上学期期中考试化学试题青海省西宁市海湖中学2022-2023学年高二上学期期末考试化学试题海南省临高县新盈中学2021-2022学年高二上学期(1-4班)期中考试化学试题第3课时 反应焓变的计算第一章 第二节 反应热的计算四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题宁夏石嘴山三中2015~2016学年度高二上学期期末化学试卷【解析版】广东省江门市新会第一中学2023-2024学年高二上学期期末考试化学试题四川省泸州市泸县第四中学2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 工业上利用 和
和 反应生成甲醇,也是减少
反应生成甲醇,也是减少 的一种方法。在容积为1L的恒温密闭容器中充入
的一种方法。在容积为1L的恒温密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: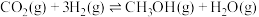
 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
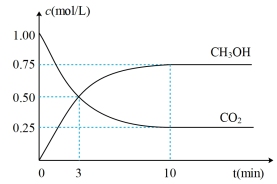
(1)达到平衡的时刻是_______ min(填“3”或“10”)。在前10min内,用 浓度的变化表示的反应速率
浓度的变化表示的反应速率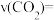
_______ mol/(L•min)。
(2)能判断该反应达到化学平衡状态的依据是_______。
(3)达平衡后, 的转化率是
的转化率是_______ 。平衡常数K=_______ (计算结果保留一位小数)。
(4)工业上也可用CO和 合成甲醇
合成甲醇
已知:①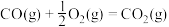

②

③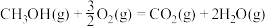

则反应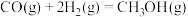

_______ kJ/mol
 和
和 反应生成甲醇,也是减少
反应生成甲醇,也是减少 的一种方法。在容积为1L的恒温密闭容器中充入
的一种方法。在容积为1L的恒温密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: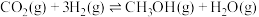
 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
(1)达到平衡的时刻是
 浓度的变化表示的反应速率
浓度的变化表示的反应速率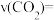
(2)能判断该反应达到化学平衡状态的依据是_______。
| A.容器内压强不变 | B.混合气体中 不变 不变 |
C. | D.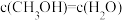 |
(3)达平衡后,
 的转化率是
的转化率是(4)工业上也可用CO和
 合成甲醇
合成甲醇已知:①
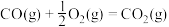

②


③
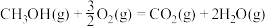

则反应

您最近一年使用:0次
名校
3 . 中国明确提出2030年“碳达峰”与2060年“碳中和”目标。 选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下,
选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下, 、
、 均可与
均可与 发生甲烷化反应:
发生甲烷化反应:
Ⅰ.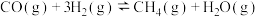
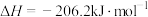
Ⅱ.
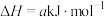
回答下列问题:
(1)已知
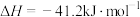 ,则
,则
_______ 。
(2)请从平衡移动的角度,提出三种可行的操作提高反应Ⅰ中 的转化率
的转化率_______ 、_______ 、_______ 。
(3)400℃时,选用镍基催化剂,向 密闭容器中通入
密闭容器中通入 、
、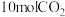 和
和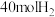 进行反应,平衡后测得
进行反应,平衡后测得 ,
,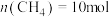 。
。
① 的平衡转化率为
的平衡转化率为_______ 。
②反应Ⅱ平衡常数K的数值最接近下列哪个数值_______ (填字母)。
A.20 B.2 C.0.2 D.0.02
(4)其他条件相同,反应Ⅱ使用两种不同催化剂,反应相同的时间,测得 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。
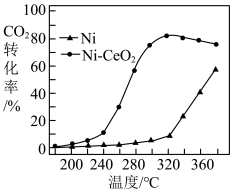
①请解释使用 催化剂时,随着温度的升高,为何
催化剂时,随着温度的升高,为何 转化率先升高后降低
转化率先升高后降低_____ ?
②根据图像分析,下列说法错误的是_______ (填字母)。
A.在200~360℃范围内, 的催化效果比
的催化效果比 更好
更好
B.可以通过改变催化剂种类的方式调控 平衡转化率
平衡转化率
C.在240℃附近,可以通过延长反应时间的方式提高 的转化率
的转化率
(5) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
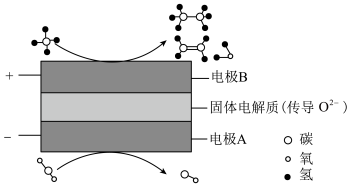
①阴极上的反应式为_______ 。
②阳极上生成乙烯 和乙烷
和乙烷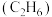 的反应式分别为
的反应式分别为_______ 和_______ 。
③若生成的乙烯 和乙烷
和乙烷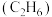 的体积比为
的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
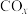 选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下,
选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下, 、
、 均可与
均可与 发生甲烷化反应:
发生甲烷化反应:Ⅰ.
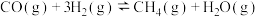
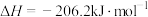
Ⅱ.

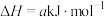
回答下列问题:
(1)已知

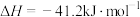 ,则
,则
(2)请从平衡移动的角度,提出三种可行的操作提高反应Ⅰ中
 的转化率
的转化率(3)400℃时,选用镍基催化剂,向
 密闭容器中通入
密闭容器中通入 、
、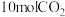 和
和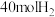 进行反应,平衡后测得
进行反应,平衡后测得 ,
,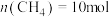 。
。①
 的平衡转化率为
的平衡转化率为②反应Ⅱ平衡常数K的数值最接近下列哪个数值
A.20 B.2 C.0.2 D.0.02
(4)其他条件相同,反应Ⅱ使用两种不同催化剂,反应相同的时间,测得
 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。
①请解释使用
 催化剂时,随着温度的升高,为何
催化剂时,随着温度的升高,为何 转化率先升高后降低
转化率先升高后降低②根据图像分析,下列说法错误的是
A.在200~360℃范围内,
 的催化效果比
的催化效果比 更好
更好B.可以通过改变催化剂种类的方式调控
 平衡转化率
平衡转化率C.在240℃附近,可以通过延长反应时间的方式提高
 的转化率
的转化率(5)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
①阴极上的反应式为
②阳极上生成乙烯
 和乙烷
和乙烷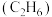 的反应式分别为
的反应式分别为③若生成的乙烯
 和乙烷
和乙烷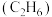 的体积比为
的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
名校
4 . 中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
① CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
② CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法不正确 的是
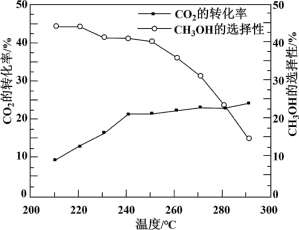
【注】CH3OH的选择性=
① CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol② CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法

【注】CH3OH的选择性=

A.CO(g) + 2H2(g) CH3OH(g) ΔH=- 90.6 kJ/mol CH3OH(g) ΔH=- 90.6 kJ/mol |
| B.使用催化剂,能降低反应的活化能,增大活化分子百分数 |
| C.其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行 |
| D.220~240 ℃,升高温度,对反应②速率的影响比对反应①的小 |
您最近一年使用:0次
2023-02-16更新
|
613次组卷
|
13卷引用:北京一零一中学2022-2023学年高三上学期统练六化学试题
北京一零一中学2022-2023学年高三上学期统练六化学试题北京市第一六一中学2022-2023学年高三上学期10月月考化学试题北京市第二十中学2022-2023学年高三下学期开学检测化学试题北京市一0一中学2022-2023学年高二下学期期中考试化学试题新疆阿克苏地区等2地新疆生产建设兵团第一师第二高级中学等2校2022-2023学年高三下学期2月月考化学试题福建省南平第一中学2023-2024学年高三上学期10月月考化学试题 北京市回民学校2023-2024学年高三上学期统练二化学试题北京市西城区2021~2022学年高三上学期期末考试化学试题北京市北京师范大学附属中学2022-2023学年高二上学期期中考试化学试题广东省广州市实验外语学校2023-2024学年高二上学期11月期中考试化学试题北京市第十五中学2023-2024学年高二上学期期中考试化学试题北京市育才学校2023-2024学年高一上学期化学期中试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题
名校
解题方法
5 .  、
、 下,①
下,①
②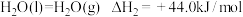
下列说法不正确 的是
 、
、 下,①
下,①
②
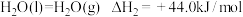
下列说法
| A.液态水变为水蒸气破坏的是分子间作用力 |
| B.水分解为氢气和氧气,断键吸收的总能量大于成键放出的总能量 |
C.标准状况下, 水中含共用电子对总数约为 水中含共用电子对总数约为 |
D. 、 、 下, 下,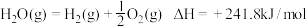 |
您最近一年使用:0次
2023-01-05更新
|
647次组卷
|
4卷引用:北京市一零一中学2022-2023学年高三下学期3月统练二化学试题
名校
解题方法
6 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
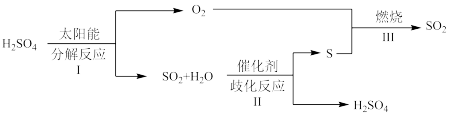
(1)反应Ⅰ由两步反应组成,写出②的化学方程式:
①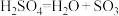 ;
;
②_______ 。
(2)反应Ⅱ: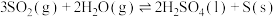 ∆H
∆H
①不同条件下, 达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H
达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H_______ 0。
②一定压强下, 与
与 的投料比[
的投料比[ ]对平衡体系中
]对平衡体系中 转化率影响如图:
转化率影响如图:
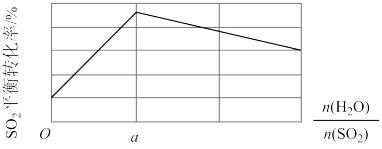
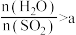 时,解释
时,解释 平衡转化率随投料比增大而降低的原因:
平衡转化率随投料比增大而降低的原因:_______ 。
(3) 可以作为水溶液中
可以作为水溶液中 歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整
歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整_______
ⅰ.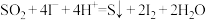
ⅱ.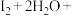 _______
_______ _______
_______ _______
_______
(4)探究ⅰ、ⅱ反应速率与 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
①B是A的对比实验,则a=_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明, 的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:_______ 。
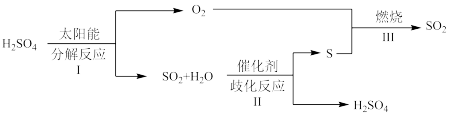
(1)反应Ⅰ由两步反应组成,写出②的化学方程式:
①
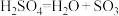 ;
;②
(2)反应Ⅱ:
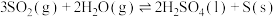 ∆H
∆H①不同条件下,
 达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H
达到相同的平衡转化率,温度越高,所需的压强越大,说明∆H②一定压强下,
 与
与 的投料比[
的投料比[ ]对平衡体系中
]对平衡体系中 转化率影响如图:
转化率影响如图:
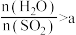 时,解释
时,解释 平衡转化率随投料比增大而降低的原因:
平衡转化率随投料比增大而降低的原因:(3)
 可以作为水溶液中
可以作为水溶液中 歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整
歧化反应(歧化反应生成硫酸与硫沉淀)的催化剂,可能的催化过程如下。将ⅱ补充完整ⅰ.
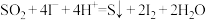
ⅱ.
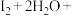 _______
_______ _______
_______ _______
_______
(4)探究ⅰ、ⅱ反应速率与
 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 序号 | A | B | C | D |
| 试剂组成 | 0.4 KI KI | a KI,0.2 KI,0.2  | 0.2  | 0.2 KI,0.0002mol KI,0.0002mol  |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,
 的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
您最近一年使用:0次
名校
7 . 将 富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。
富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。
(1)一种富集烟气中 的方法示意图如下:
的方法示意图如下:

写出“解吸”过程产生 的化学方程式:
的化学方程式:_______ 。
(2) 性质稳定,使其活化是实现转化的重要前提。
性质稳定,使其活化是实现转化的重要前提。
①使用过渡金属作催化剂,提供空轨道接受_______ (填“C”或“O”)原子的孤电子对,破坏 的结构使其活化。
的结构使其活化。
②采用电化学、光化学等手段,使
_______ (填“提供”或“接受”)电子转化为
(3) 与
与 在催化剂作用下可转化为
在催化剂作用下可转化为 ,体系中发生的主要反应如下:
,体系中发生的主要反应如下:
i.
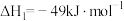
ii.

研究表明,CO与 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:_______ 。
(4)在催化剂作用下,将1mol 、3mol
、3mol 投入反应器,反应温度对
投入反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性
选择性 的影响如下。
的影响如下。
已知:

① 随温度升高逐渐增大、
随温度升高逐渐增大、 随温度升高逐渐减小的原因是
随温度升高逐渐减小的原因是_______ 。
②在240℃达到平衡时,体系_______ (填“吸收”或“放出”)的热量为_______ kJ(除了反应ⅰ和ⅱ不考虑其他反应)。
 富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。
富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。(1)一种富集烟气中
 的方法示意图如下:
的方法示意图如下:
写出“解吸”过程产生
 的化学方程式:
的化学方程式:(2)
 性质稳定,使其活化是实现转化的重要前提。
性质稳定,使其活化是实现转化的重要前提。①使用过渡金属作催化剂,提供空轨道接受
 的结构使其活化。
的结构使其活化。②采用电化学、光化学等手段,使

(3)
 与
与 在催化剂作用下可转化为
在催化剂作用下可转化为 ,体系中发生的主要反应如下:
,体系中发生的主要反应如下:i.

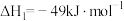
ii.


研究表明,CO与
 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(4)在催化剂作用下,将1mol
 、3mol
、3mol 投入反应器,反应温度对
投入反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性
选择性 的影响如下。
的影响如下。已知:


①
 随温度升高逐渐增大、
随温度升高逐渐增大、 随温度升高逐渐减小的原因是
随温度升高逐渐减小的原因是②在240℃达到平衡时,体系
您最近一年使用:0次
2022-11-04更新
|
215次组卷
|
3卷引用:北京市第二十中学2022-2023学年高三上学期12月月考化学试题
名校
8 . 2022北京冬奥会采用氢气作为火炬燃料,选择氢能汽车作为赛事交通服务用车,充分体现了绿色奥运的理念。已知:
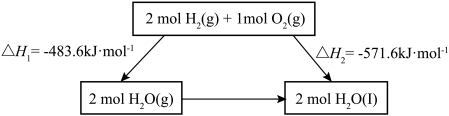
下列说法不正确 的是

下列说法
| A.氢气既可以通过燃烧反应提供热能,也可以设计成燃料电池提供电能 |
B. 的过程中, 的过程中, , , |
C.断裂2mol 和1mol 和1mol 中化学键所需能量大于断裂2mol 中化学键所需能量大于断裂2mol 中化学键所需能量 中化学键所需能量 |
D.化学反应的 ,只与反应体系的始态和终态有关,与反应途径无关 ,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2022-11-04更新
|
616次组卷
|
9卷引用:北京市第二十中学2022-2023学年高三上学期12月月考化学试题
名校
9 . 已知:① 2H2(g) + O2(g) = 2H2O(l) ΔH = -572 kJ/mol
② 2H2 (g) + SO2 (g) S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
③ 2H2 (g) + CO (g) CH3OH (g) ΔH =-90.8 kJ/mol
CH3OH (g) ΔH =-90.8 kJ/mol
(1)上述变化过程中放出热量的是_______ (填序号,下同),吸收热量的是_______ 。
(2)反应①热量变化为57.2kJ,转化H2的质量是_______ g。
(3)反应②2 g H2 (g) 完全反应生成硫单质时,ΔH =_______ kJ/mol。
(4)反应③2molH2和1molCO放入密闭容器中充分反应,放出的热量_______ 90.8KJ(填“大于”或“小于”或“等于”)
② 2H2 (g) + SO2 (g)
 S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol③ 2H2 (g) + CO (g)
 CH3OH (g) ΔH =-90.8 kJ/mol
CH3OH (g) ΔH =-90.8 kJ/mol(1)上述变化过程中放出热量的是
(2)反应①热量变化为57.2kJ,转化H2的质量是
(3)反应②2 g H2 (g) 完全反应生成硫单质时,ΔH =
(4)反应③2molH2和1molCO放入密闭容器中充分反应,放出的热量
您最近一年使用:0次
2022-10-12更新
|
128次组卷
|
2卷引用:北京市首都师范大学附属中学2023-2024学年高二上学期9月检测化学试题
名校
10 . 在T℃, 气体通过铁管时,发生腐蚀反应(X):
气体通过铁管时,发生腐蚀反应(X):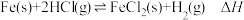 (K=0.33),下列分析不正确的是
(K=0.33),下列分析不正确的是
 气体通过铁管时,发生腐蚀反应(X):
气体通过铁管时,发生腐蚀反应(X):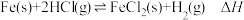 (K=0.33),下列分析不正确的是
(K=0.33),下列分析不正确的是| A.降低反应温度,可减缓反应X的速率 |
B.在 气体中加入一定量 气体中加入一定量 能起到防护铁管的作用 能起到防护铁管的作用 |
C.反应X的 可通过如下反应获得: 可通过如下反应获得: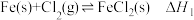 、 、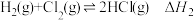 |
D.T℃时,若气体混合物中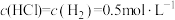 ,铁管被腐蚀 ,铁管被腐蚀 |
您最近一年使用:0次
2022-04-01更新
|
1061次组卷
|
13卷引用:北京一零一中学2022-2023学年高三上学期统练六化学试题
北京一零一中学2022-2023学年高三上学期统练六化学试题北京市第一○一中学2023-2024学年高二上学期统练一化学试题福建省龙岩第一中学2022-2023学年高二上学期第三次月考化学试题山东省滕州市第一中学2023-2024学年高二上学期10月月考化学试题辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题北京市中关村中学2023-2024学年高二上学期期中考试化学试题北京市朝阳区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)(已下线)化学-2022年高考考前押题密卷(广东卷)湖南省娄底市第五中学2021-2022学年高三下学期第三次模拟考试化学试题福建省厦门第一中学2022-2023学年高二上学期期中考试化学试题山东省青岛第二中学2022-2023学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2023-2024学年高二上学期期中考试化学试题



