1 . 向丙烷脱氢制丙烯的反应体系中加入 ,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的
,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的 、
、 混合气体以相同流速持续通过同种催化剂表面,
混合气体以相同流速持续通过同种催化剂表面, 转化率和
转化率和 选择性随通入气体时间的变化如图:
选择性随通入气体时间的变化如图:
I.反应①
反应②
Ⅱ.反应体系中存在 的裂解和生成积炭等副反应。
的裂解和生成积炭等副反应。
Ⅲ. 的选择性
的选择性
下列说法正确的是
 ,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的
,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的 、
、 混合气体以相同流速持续通过同种催化剂表面,
混合气体以相同流速持续通过同种催化剂表面, 转化率和
转化率和 选择性随通入气体时间的变化如图:
选择性随通入气体时间的变化如图:
I.反应①

反应②

Ⅱ.反应体系中存在
 的裂解和生成积炭等副反应。
的裂解和生成积炭等副反应。Ⅲ.
 的选择性
的选择性
下列说法正确的是
A. |
B.30min内,两体系中 选择性相同,生成 选择性相同,生成 的速率也相同 的速率也相同 |
C.iii中的 转化率高于iv中的,是因为反应②使反应①的平衡正向移动 转化率高于iv中的,是因为反应②使反应①的平衡正向移动 |
D.iii、iv对比,150min后iv中 转化率为0,可能是因为积炭使催化剂失效 转化率为0,可能是因为积炭使催化剂失效 |
您最近一年使用:0次
名校
解题方法
2 . CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H2
CH3OCH3(g)+3H2O(g) △H2
恒压,投入1 mol CO2和适当过量的H2,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=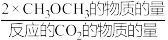 ×100%
×100%
下列说法中不正确 的是
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H2
CH3OCH3(g)+3H2O(g) △H2恒压,投入1 mol CO2和适当过量的H2,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
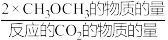 ×100%
×100%下列说法中
| A.△H1>0,△H2<0 |
| B.温度高于300℃,反应Ⅰ正移程度超过反应Ⅱ逆移程度 |
| C.220℃时,反应一段时间后,测得CH3OCH3的选择性为48%(即图中A点)。此时反应Ⅰ和Ⅱ均未达到平衡状态 |
| D.若平衡时CH3OCH3的选择性为48%,则体系中c(CH3OCH3)∶c(CO)=48∶52 |
您最近一年使用:0次
2023-05-30更新
|
693次组卷
|
2卷引用:北京市第一○一中学2023届高三下学期三模化学试题
名校
解题方法
3 . 二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
(1)已知下列热化学方程式:
反应Ⅰ:
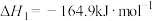
反应Ⅱ:

则反应

___________  。
。
(2)向恒压密闭容器中通入 、
、 ,分别在
,分别在 和
和 下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和
下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和 的选择性
的选择性 与温度变化关系如图所示、
与温度变化关系如图所示、


定义:
 ×100%
×100%
①下列叙述能判断反应体系达到平衡的是___________ (填字母序号)。
A. 的消耗速率和
的消耗速率和 的消耗速率相等
的消耗速率相等
B.混合气体的密度不再发生变化
C.容器内压强不再发生变化
②图中表示 时
时 随温度变化关系的曲线是
随温度变化关系的曲线是___________ (填字母),理由是___________ 。
③550℃、 条件下,上述容器通入气体的初始体积为
条件下,上述容器通入气体的初始体积为 ,则平衡时容器体积为
,则平衡时容器体积为___________ 。
(3)一种从高炉气回收 制储氢物质
制储氢物质 的综合利用示意图如图所示:
的综合利用示意图如图所示:

已知:T温度下, ,
,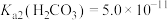
①T温度下,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中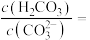
___________ 。
②铂电极上 电催化还原为
电催化还原为 ,该电极反应方程式为
,该电极反应方程式为___________ 。
铂电极上的副反应除析氢外,没有其它放电过程。若生成 的电解效率
的电解效率 %。当电路中转移
%。当电路中转移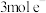 时,阴极窒溶液的质量增加
时,阴极窒溶液的质量增加___________ g。
定义: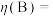

(1)已知下列热化学方程式:
反应Ⅰ:

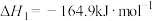
反应Ⅱ:


则反应


 。
。(2)向恒压密闭容器中通入
 、
、 ,分别在
,分别在 和
和 下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和
下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和 的选择性
的选择性 与温度变化关系如图所示、
与温度变化关系如图所示、

定义:

 ×100%
×100%①下列叙述能判断反应体系达到平衡的是
A.
 的消耗速率和
的消耗速率和 的消耗速率相等
的消耗速率相等B.混合气体的密度不再发生变化
C.容器内压强不再发生变化
②图中表示
 时
时 随温度变化关系的曲线是
随温度变化关系的曲线是③550℃、
 条件下,上述容器通入气体的初始体积为
条件下,上述容器通入气体的初始体积为 ,则平衡时容器体积为
,则平衡时容器体积为(3)一种从高炉气回收
 制储氢物质
制储氢物质 的综合利用示意图如图所示:
的综合利用示意图如图所示:
已知:T温度下,
 ,
,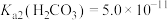
①T温度下,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中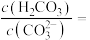
②铂电极上
 电催化还原为
电催化还原为 ,该电极反应方程式为
,该电极反应方程式为铂电极上的副反应除析氢外,没有其它放电过程。若生成
 的电解效率
的电解效率 %。当电路中转移
%。当电路中转移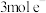 时,阴极窒溶液的质量增加
时,阴极窒溶液的质量增加定义:
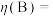

您最近一年使用:0次
名校
解题方法
4 . 光解水制氢的关键步骤是水的氧化。我国科学家用仿生催化剂[用 表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下:
表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下:不正确 的是
 表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下:
表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下: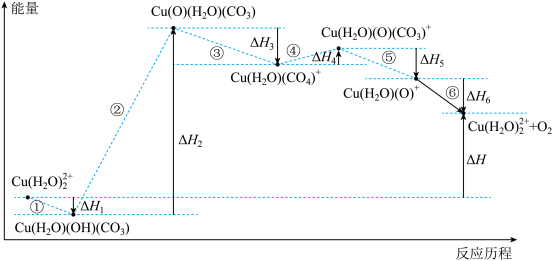
A.步骤①可表示为 |
B.水的氧化反应为: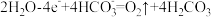 |
C. |
| D.催化剂参与反应,降低活化能,加快反应速率 |
您最近一年使用:0次
2023-05-07更新
|
1264次组卷
|
9卷引用:北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题
北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题福建省厦门第一中学2023届高三下学期模拟考试化学试题湖北省武汉市洪山高级中学2024届高三下学期第 2次模拟考试化学试卷 (已下线)专题08 化学反应中的能量变化(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题16-20北京交通大学附属中学2023-2024学年高三下学期3月月考化学试题
名校
解题方法
5 .  资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
I. 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:
i.催化剂活化: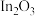 (无活性)
(无活性)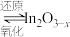 (有活性)
(有活性)
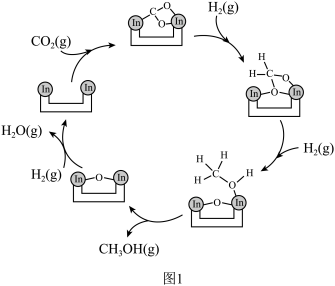
ii. 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。
同时伴随反应②:
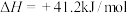
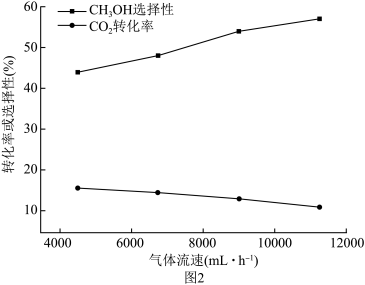
(1)反应①中每生成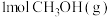 放热49.3kJ,写出其热化学方程式
放热49.3kJ,写出其热化学方程式__________ 。
(2) 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知: 选择性
选择性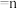 (生成
(生成 所消耗的
所消耗的 的量)
的量)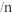 (发生转化的
(发生转化的 的量)
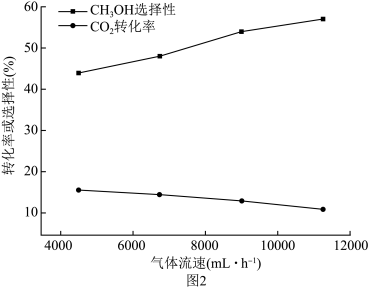
的量) 选择性随流速增大而升高的原因
选择性随流速增大而升高的原因____________________ 。
同时,流速加快可减少产物中 的积累,减少反应
的积累,减少反应__________ (用化学方程式表示)的发生,减少催化剂的失活,提高甲醇选择性。
(3)对于以上 制甲醇的过程,以下描述正确的是__________
制甲醇的过程,以下描述正确的是__________
II.甲醇燃料电池(DMFC)示意图如图。电极A、B均浸泡于稀硫酸中。 可在聚合物电解质自由移动,其余微粒均无法通过聚合物电解质。
可在聚合物电解质自由移动,其余微粒均无法通过聚合物电解质。
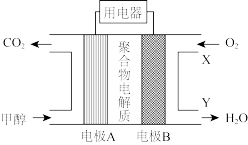
(4)①电极A上发生的电极反应为__________ ;
②X口、Y口两处硫酸溶液的浓度关系为
__________  (填“>”、“=”或“<”),原因是
(填“>”、“=”或“<”),原因是__________ 。
 资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。I.
 制甲醇。以
制甲醇。以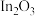 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:i.催化剂活化:
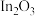 (无活性)
(无活性)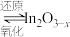 (有活性)
(有活性)ii.
 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②:

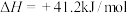


(1)反应①中每生成
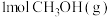 放热49.3kJ,写出其热化学方程式
放热49.3kJ,写出其热化学方程式(2)
 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。已知:
 选择性
选择性 (生成
(生成 所消耗的
所消耗的 的量)
的量) (发生转化的
(发生转化的 的量)
的量) 选择性随流速增大而升高的原因
选择性随流速增大而升高的原因同时,流速加快可减少产物中
 的积累,减少反应
的积累,减少反应(3)对于以上
 制甲醇的过程,以下描述正确的是__________
制甲醇的过程,以下描述正确的是__________| A.碳的杂化方式发生了改变 | B.反应中经历了 、 、 键的形成和断裂 键的形成和断裂 |
C.加压可以提高 的平衡转化率 的平衡转化率 | D.升高温度可以提高甲醇在平衡时的选择性 |
II.甲醇燃料电池(DMFC)示意图如图。电极A、B均浸泡于稀硫酸中。
 可在聚合物电解质自由移动,其余微粒均无法通过聚合物电解质。
可在聚合物电解质自由移动,其余微粒均无法通过聚合物电解质。
(4)①电极A上发生的电极反应为
②X口、Y口两处硫酸溶液的浓度关系为
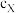
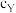 (填“>”、“=”或“<”),原因是
(填“>”、“=”或“<”),原因是
您最近一年使用:0次
2022-12-24更新
|
851次组卷
|
4卷引用:北京市中国人民大学附属中学2022-2023学年高三上学期统练6化学试题
名校
解题方法
6 . 实现二氧化碳选择性、稳定性加氢合成甲醇是“甲醇经济”理念下的一个重要成果。由CO2和H2合成CH3OH的反应过程如下:
I.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+40.9kJ·mol-1
CO(g)+H2O(g) △H1=+40.9kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1
回答下列问题:
(1)如图是一种特定条件下反应I机理中的第一步变化,则碳原子的杂化类型从____ 变为___ 。
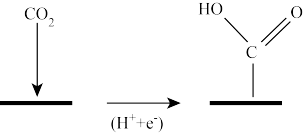
(2)写出由CO2和H2合成CH3OH的热化学方程式为____ 。
(3)恒压条件下,按n(CO2):n(H2)=1:3投料时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出H2O)
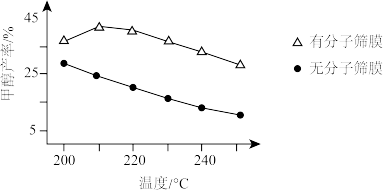
①根据图中数据,恒压条件下采用有分子筛膜时的最佳反应温度为____ ℃。
②有分子筛膜时甲醇产率高的原因是____ 。
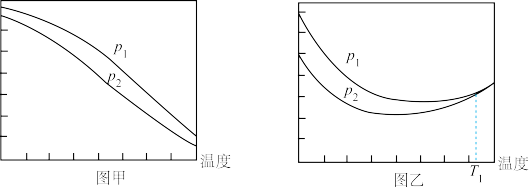
(4)不同压强下,依然按n(CO2):n(H2)=1:3投料,测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
已知:CO2的平衡转化率=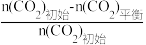 ×100%
×100%
CH3OH的平衡产率= ×100%
×100%
①压强:p1____ p2(填“>”“=”或“<”),判断依据是____ 。
②纵坐标表示CO2平衡转化率的是图____ (填“甲”或“乙”)。
③图乙中T1温度时,两条曲线几乎交于一点的原因是____ 。
I.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+40.9kJ·mol-1
CO(g)+H2O(g) △H1=+40.9kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1回答下列问题:
(1)如图是一种特定条件下反应I机理中的第一步变化,则碳原子的杂化类型从

(2)写出由CO2和H2合成CH3OH的热化学方程式为
(3)恒压条件下,按n(CO2):n(H2)=1:3投料时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出H2O)

①根据图中数据,恒压条件下采用有分子筛膜时的最佳反应温度为
②有分子筛膜时甲醇产率高的原因是
(4)不同压强下,依然按n(CO2):n(H2)=1:3投料,测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

已知:CO2的平衡转化率=
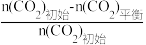 ×100%
×100%CH3OH的平衡产率=
 ×100%
×100%①压强:p1
②纵坐标表示CO2平衡转化率的是图
③图乙中T1温度时,两条曲线几乎交于一点的原因是
您最近一年使用:0次
7 . 一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
(1)已知:
①

②

③

④
则
_______ (用 、
、 、
、 表示)。
表示)。
(2)反应④的反应温度、投料比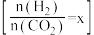 对
对 平衡转化率的影响如图所示。
平衡转化率的影响如图所示。

①a_______ 3(填“>”、“<”或“=”);M、N两点反应的平衡常数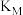
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②300℃,往6L反应容器中加入 、
、 ,反应10min达到平衡。求0到10min氢气的平均反应速率为
,反应10min达到平衡。求0到10min氢气的平均反应速率为_______ 。
(3)中科院兰州化学物理研究所用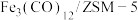 催化
催化 加氢合成低碳烯烃反应,所得产物含
加氢合成低碳烯烃反应,所得产物含 、
、 、
、 等副产物,反应过程如图。
等副产物,反应过程如图。
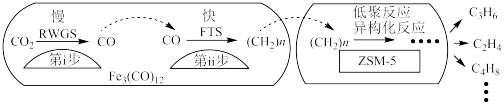
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得 转化率和各产物的物质的量分数如下表。
转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在 中添加
中添加_______ 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_______ ;
②下列说法正确的是_______ ;
a.第ⅰ步所反应为:
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d. 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
e.添加不同助剂后,反应的平衡常数各不相同
(4)2018年,强碱性电催化还原 制乙烯研究取得突破进展,原理如图所示。
制乙烯研究取得突破进展,原理如图所示。

①b极接的是太阳能电池的_______ 极;
②已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式_______ 。
(1)已知:
①


②


③


④

则

 、
、 、
、 表示)。
表示)。(2)反应④的反应温度、投料比
 对
对 平衡转化率的影响如图所示。
平衡转化率的影响如图所示。
①a
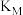
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②300℃,往6L反应容器中加入
 、
、 ,反应10min达到平衡。求0到10min氢气的平均反应速率为
,反应10min达到平衡。求0到10min氢气的平均反应速率为(3)中科院兰州化学物理研究所用
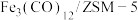 催化
催化 加氢合成低碳烯烃反应,所得产物含
加氢合成低碳烯烃反应,所得产物含 、
、 、
、 等副产物,反应过程如图。
等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得
 转化率和各产物的物质的量分数如下表。
转化率和各产物的物质的量分数如下表。| 助剂 |  转化率(%) 转化率(%) | 各产物在所有产物中的占比(%) | ||
 |  | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
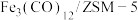 中添加
中添加②下列说法正确的是
a.第ⅰ步所反应为:

b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.
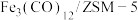 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小e.添加不同助剂后,反应的平衡常数各不相同
(4)2018年,强碱性电催化还原
 制乙烯研究取得突破进展,原理如图所示。
制乙烯研究取得突破进展,原理如图所示。
①b极接的是太阳能电池的
②已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式
您最近一年使用:0次
名校
8 .  资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
Ⅰ. 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:
ⅰ.催化剂活化: (无活性)
(无活性) (有活性)
(有活性)
ⅱ. 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②:
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②: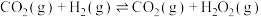
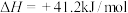
(1)反应①中每生成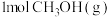 放热49.3kJ,写出其热化学方程式
放热49.3kJ,写出其热化学方程式_______ 。
(2) 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。已知:
选择性的关系如图2。已知: 选择性=
选择性= ,
, 选择性随流速增大而升高的原因
选择性随流速增大而升高的原因_______ 。同时,流速加快可减少产物中 的积累,减少反应
的积累,减少反应_______ (用化学方程式表示)的发生,减少催化剂的失活,提高甲醇选择性。
(3)对于以上 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。
Ⅱ. 制汽油。我国科学家将
制汽油。我国科学家将 与另一催化剂HZSM联用,可将
与另一催化剂HZSM联用,可将 转化为汽油(以
转化为汽油(以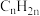 表示)。
表示)。
(4)将催化剂HZSM表面发生的反应补全:_______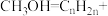 _______。
_______。_______
(5)其他条件不变,向原料气中添加不同量的CO,反应相同时间后,测得 的产量随CO的增加有明显提升。
的产量随CO的增加有明显提升。
原因一: 增大,反应②平衡逆移,
增大,反应②平衡逆移, 、
、 增大,反应①平衡正移,
增大,反应①平衡正移, 增大,生成
增大,生成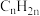 的速率加快。
的速率加快。
原因二:_______,反应①速率加快, 增大,生成
增大,生成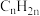 的速率加快。
的速率加快。
补全原因二_______
 资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。Ⅰ.
 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:ⅰ.催化剂活化:
 (无活性)
(无活性) (有活性)
(有活性)ⅱ.
 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②:
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②: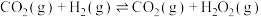
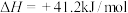

(1)反应①中每生成
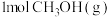 放热49.3kJ,写出其热化学方程式
放热49.3kJ,写出其热化学方程式(2)
 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。已知:
选择性的关系如图2。已知: 选择性=
选择性= ,
, 选择性随流速增大而升高的原因
选择性随流速增大而升高的原因 的积累,减少反应
的积累,减少反应
(3)对于以上
 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。| A.碳的杂化方式发生了改变 | B.反应中经历了In-C、In-O键的形成和断裂 |
C.加压可以提高 的平衡转化率 的平衡转化率 | D.升高温度可以提高甲醇在平衡时的选择性 |
Ⅱ.
 制汽油。我国科学家将
制汽油。我国科学家将 与另一催化剂HZSM联用,可将
与另一催化剂HZSM联用,可将 转化为汽油(以
转化为汽油(以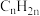 表示)。
表示)。(4)将催化剂HZSM表面发生的反应补全:_______
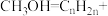 _______。
_______。(5)其他条件不变,向原料气中添加不同量的CO,反应相同时间后,测得
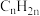 的产量随CO的增加有明显提升。
的产量随CO的增加有明显提升。原因一:
 增大,反应②平衡逆移,
增大,反应②平衡逆移, 、
、 增大,反应①平衡正移,
增大,反应①平衡正移, 增大,生成
增大,生成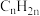 的速率加快。
的速率加快。原因二:_______,反应①速率加快,
 增大,生成
增大,生成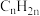 的速率加快。
的速率加快。补全原因二
您最近一年使用:0次
名校
9 . 水分子中存在氢键,氢键的形成赋予物质一些特殊的性质。
下列说法不正确 的是
 |  |
| 水分子中的氢键 | 冰晶体中的孔穴示意图 |
A.水分子间形成氢键,可彼此结合形成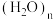 ,氢键可表示为O—H…O ,氢键可表示为O—H…O |
B.冰中的水分子之间最大限度地形成氢键,每个水分子的两个孤电子对和两个氢原子沿着 杂化轨道的方向彼此形成氢键,每1mol冰含有2mol氢键 杂化轨道的方向彼此形成氢键,每1mol冰含有2mol氢键 |
| C.根据冰的升华热为51kJ/mol,冰晶体中范德华力作用能为11 kJ/mol,可推知氢键的作用能为40 kJ/mol |
| D.羊毛纤维(含蛋白质)水洗后会变形,与氢键有关 |
您最近一年使用:0次
名校
解题方法
10 . 工业上利用碳热还原BaSO4制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。

已知:碳热还原BaSO4过程中可能发生下列反应。
i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) △H1
ii.BaSO4(s)+4C(s)=4CO(g)+BaS(s) △H2=+571.2kJ·mol-1
iii.BaSO4(s)+4CO(g)=4CO2(g)+BaS(s) △H3=-118.8kJ·mol-1
下列关于碳热还原BaSO4过程的说法正确的是

已知:碳热还原BaSO4过程中可能发生下列反应。
i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) △H1
ii.BaSO4(s)+4C(s)=4CO(g)+BaS(s) △H2=+571.2kJ·mol-1
iii.BaSO4(s)+4CO(g)=4CO2(g)+BaS(s) △H3=-118.8kJ·mol-1
下列关于碳热还原BaSO4过程的说法正确的是
| A.△H1=+113.1kJ·mol-1 |
B.400℃后,反应后组分的变化是由C(s)+CO2(g) 2CO(g)的移动导致的 2CO(g)的移动导致的 |
C.温度升高,C(s)+CO2(g) 2CO(g)的平衡常数K减小 2CO(g)的平衡常数K减小 |
| D.反应过程中,生成的CO2和CO的物质的量之和始终等于投入C的物质的量 |
您最近一年使用:0次
2022-05-15更新
|
1258次组卷
|
7卷引用:北京市海淀区2022届高三二模化学试题
北京市海淀区2022届高三二模化学试题北京市海淀区2021-2022学年高三下学期期末练习化学试题(已下线)2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题(已下线)第七章 化学反应速率和化学平衡(测)-2023年高考化学一轮复习讲练测(全国通用)北京市中国人民大学附属中学2023-2024学年高三上学期11月统练三 化学试题广东省深圳市蛇口育才教育集团育才中学2023-2024学年高二上学期阶段检测(一)化学试题广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题



