名校
1 . 已知:C(s)+O2(g)=CO2(g) △H1=-395kJ/mol,
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于
| A.-112 kJ/mol | B.-395 kJ/mol | C.+ 112 kJ/mol | D.-283 kJ/mol |
您最近一年使用:0次
2016-11-29更新
|
255次组卷
|
3卷引用:山西省阳泉二中2018-2019学年高二上学期期中考试化学试题
2 . 氯原子对O3的分解有催化作用:
O3+Cl=ClO+O2∆H1
ClO+O=Cl+O2∆H2
大气臭氧层的分解反应是O3+O=2O2∆H,该反应的能量变化如图,下列叙述正确的是()
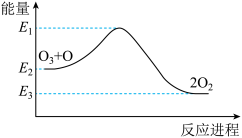
O3+Cl=ClO+O2∆H1
ClO+O=Cl+O2∆H2
大气臭氧层的分解反应是O3+O=2O2∆H,该反应的能量变化如图,下列叙述正确的是()

| A.反应O3+O=2O2的∆H=E2-E3 |
| B.O3+O=2O2的逆反应的活化能为E3-E1 |
| C.∆H=∆H1+∆H2 |
| D.2O2=O3+O是放热反应 |
您最近一年使用:0次
名校
解题方法
3 . 化学反应中的热量问题,对于化工生产有重要的意义
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=_______ kJ/mol。
(2)已知在微生物作用条件下, 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:_______ 。
(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为_______ (填“吸热”或“放热”)反应。 _______ kJ(用含a、b、c、d的代数式表示)。
(4)室温下,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示装置中进行中和反应。回答下列问题:_______ ,保持其他条件不变,实验中改用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液进行反应,与上述实验相比,二者所测的中和热_______ (填“相等”或“不相等”),原因是_______ 。
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为_______ 。
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=_______ kJ/mol(已知该温度下水的比热容:c=4.18J/(g·℃),保留三位有效数字)。
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=
(2)已知在微生物作用条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。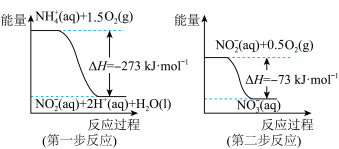
 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为
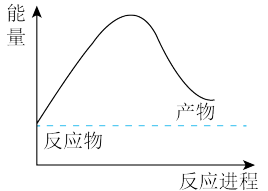
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
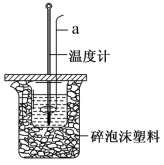
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=
您最近一年使用:0次
4 . 2023年7月28日,第31届世界大学生运动会在四川省成都市盛大开幕。已知:
回答下列问题:
(1)火炬“蓉火"采用了生物质丙烷为燃料。
①写出表示丙烷气体燃烧热的热化学方程式:_______ 。
②生物质丙烷由秸秆、稻壳、玉米芯等废弃物合成而来,与传统来自天然气加工和石油提炼的丙烷相比,其优点是_______ 。
(2)火炬“蓉火”通过优化燃料喷注和空气掺混等方式,减少了燃料的使用量,其原因是_______ 。
(3)我国科学家将甲烷无氧偶联制备乙烷和氢气,根据以上数据,计算该反应2CH4(g)=C2H6(g)+H2(g)的△H=_______ 。
| 物质 | 甲烷CH4 | 乙烷C2H6 | 丙烷C3H8 | H2 |
| 燃烧热△H/(kJ/mol) | -890.3 | -1559.8 | -2219.9 | -285.8 |
(1)火炬“蓉火"采用了生物质丙烷为燃料。
①写出表示丙烷气体燃烧热的热化学方程式:
②生物质丙烷由秸秆、稻壳、玉米芯等废弃物合成而来,与传统来自天然气加工和石油提炼的丙烷相比,其优点是
(2)火炬“蓉火”通过优化燃料喷注和空气掺混等方式,减少了燃料的使用量,其原因是
(3)我国科学家将甲烷无氧偶联制备乙烷和氢气,根据以上数据,计算该反应2CH4(g)=C2H6(g)+H2(g)的△H=
您最近一年使用:0次
名校
解题方法
5 . 我国科学家在合成气直接制烯烃方面的研究获重大突破。已知:

下列说法不正确的是

下列说法不正确的是
| A.△H1-△H2<0 |
| B.反应②为吸热反应 |
C.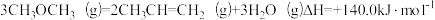 |
D.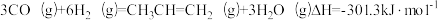 |
您最近一年使用:0次
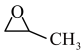
6 . 我国是世界上最大的PO (环氧丙烷,C3H6O)生产国,环氧丙烷是一种高价值化工中间体,广泛用于化工、农药汽车、纺织等行业。回答下列问题:
(1)“丙烯与氧气直接环氧化法”是最经济和绿色的PO生产途径,有关反应为2CH2=CH-CH3(g)+O2(g)→2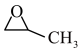 (g),该反应的△H=
(g),该反应的△H=_______ 。【已知:丙烯、环氧丙烷(C3H6O)的燃烧热(△H)分别为-2049 kJ/mol、-1887.6 kJ/mol。]
(2)在以上直接环氧化过程中,丙烯易被氧气部分氧化为丙烯醛,并进而被深度氧化为CO2.图(a)为丙烯反应速率(用★表示)、产物选择性与温度的关系曲线(以c-Cu2O纳米晶为催化剂)。
注:产物(X)选择性=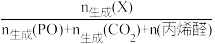 ×100%
×100%
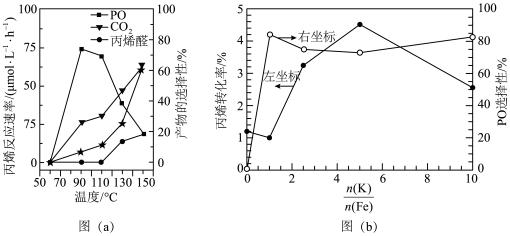
若在实际生产中选择110℃左右作为“丙烯与氧气直接环氧化法”的反应温度,其原因是_______ 。
(3)在KCl修饰的FeOx/SBA-15催化剂作用下,丙烯也可以被N2O氧化为环氧丙烷,该反应为CH2=CH-CH3(g)+N2O(g)
 (g)+N2(g)。
(g)+N2(g)。
①已知在325℃时,该催化剂中的钾铁比 对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率
对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率_______ (填“是”或“不是”)对应温度下的平衡转化率,判断理由是_______ 。
②350℃下,在一恒容密闭容器进行上述反应,已知起始压强为p(C3H6)=2.5kPa,p(N2O)=25.3kPa.忽略其他副反应,丙烯的平衡转化率为α,则平衡时的p(PO)=_______ kPa(用含a的代数式表示,下同),以上反应用平衡分压代替平衡浓度表示的平衡常数Kp=_______ (列出计算式,分压=总压×物质的量分数)。
(1)“丙烯与氧气直接环氧化法”是最经济和绿色的PO生产途径,有关反应为2CH2=CH-CH3(g)+O2(g)→2
 (g),该反应的△H=
(g),该反应的△H=(2)在以上直接环氧化过程中,丙烯易被氧气部分氧化为丙烯醛,并进而被深度氧化为CO2.图(a)为丙烯反应速率(用★表示)、产物选择性与温度的关系曲线(以c-Cu2O纳米晶为催化剂)。
注:产物(X)选择性=
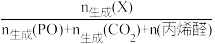 ×100%
×100%
若在实际生产中选择110℃左右作为“丙烯与氧气直接环氧化法”的反应温度,其原因是
(3)在KCl修饰的FeOx/SBA-15催化剂作用下,丙烯也可以被N2O氧化为环氧丙烷,该反应为CH2=CH-CH3(g)+N2O(g)

 (g)+N2(g)。
(g)+N2(g)。①已知在325℃时,该催化剂中的钾铁比
 对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率
对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率②350℃下,在一恒容密闭容器进行上述反应,已知起始压强为p(C3H6)=2.5kPa,p(N2O)=25.3kPa.忽略其他副反应,丙烯的平衡转化率为α,则平衡时的p(PO)=
您最近一年使用:0次
10-11高一下·山西大同·期中
7 . 下列化学方程式中,Q1、Q2、Q3表示反应所放出的热量:
① 2H2(g) + O2(g) = 2H2O (g) + Q1kJ;
② 2 H2(g) + O2(g) = 2H2O (l) + Q2kJ;
③ H2(g) + 1/2 O2(g) = H2O (g) + Q3kJ;
其中Q1、Q2、Q3的大小关系为
① 2H2(g) + O2(g) = 2H2O (g) + Q1kJ;
② 2 H2(g) + O2(g) = 2H2O (l) + Q2kJ;
③ H2(g) + 1/2 O2(g) = H2O (g) + Q3kJ;
其中Q1、Q2、Q3的大小关系为
| A.Q1= Q2= Q3 | B.2Q3= Q1< Q2 | C.Q3< Q2< Q1 | D.Q1< Q2< 3Q3 |
您最近一年使用:0次
19-20高三·浙江·阶段练习
解题方法
8 . 氢碘酸和氯水反应的能量关系如图所示。
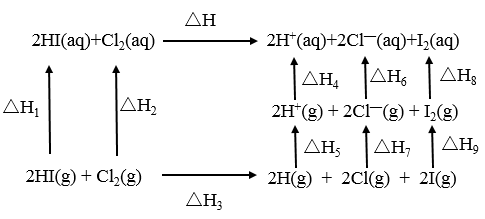
下列说法正确的是

下列说法正确的是
| A.已知HI气体溶于水放热,则ΔH1 <0 |
| B.ΔH = ΔH1 +ΔH2 + ΔH3 +ΔH4 +ΔH5 +ΔH6+ΔH7 +ΔH8 +ΔH9 |
| C.已知ΔH <0,则ΔH3 <0 |
| D.ΔH9 >0 |
您最近一年使用:0次
解题方法
9 . 由化学能产生的能量是目前人类使用的主要能源。
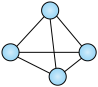
(1)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN-N键吸收167kJ热量,生成1molN N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:___ 。
(2)自嗨锅(自热火锅)的加热原理是利用发热包内的物质与水接触,释放出热量,从而使得上面隔层食材锅内的食物吸收热量后温度升高。一般自嗨锅的发热包是用碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰等组成,写出发热包中的某一物质与水发生放热反应的化学方程式:___ 。(写出一个即可)
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ,则SiH4自燃的热化学方程式为:__ 。
(4)比较下列两个热化学方程式中ΔH的大小。
4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
△H2__ △H1,(填“>”、“<"或“=")
(5)已知:2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+181kJ·mol-1
若某反应的平衡常数表达式为K=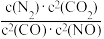 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___ 。
(1)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN-N键吸收167kJ热量,生成1molN
 N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
(2)自嗨锅(自热火锅)的加热原理是利用发热包内的物质与水接触,释放出热量,从而使得上面隔层食材锅内的食物吸收热量后温度升高。一般自嗨锅的发热包是用碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰等组成,写出发热包中的某一物质与水发生放热反应的化学方程式:
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ,则SiH4自燃的热化学方程式为:
(4)比较下列两个热化学方程式中ΔH的大小。
4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
△H2
(5)已知:2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+181kJ·mol-1
若某反应的平衡常数表达式为K=
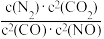 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:
您最近一年使用:0次



