名校
解题方法
1 . (1)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________________ 。
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
b.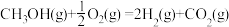 △H2
△H2
已知H2(g)+ O2(g)
O2(g)  H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
则反应②的△H2=_________ kJ·mol-1。
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。
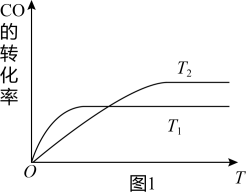

①该反应的焓变△H_____ 0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1_____ K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=_____ ,该反应的平衡常数为K=_____ 。
④恒容条件下,达到平衡后,下列措施中能使 增大的有
增大的有_____ 。
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1b.
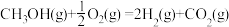 △H2
△H2已知H2(g)+
 O2(g)
O2(g)  H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1则反应②的△H2=
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。


①该反应的焓变△H
②T1和T2温度下的平衡常数大小关系是K1
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=
④恒容条件下,达到平衡后,下列措施中能使
 增大的有
增大的有A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
您最近一年使用:0次
2017-12-05更新
|
236次组卷
|
3卷引用:山西省运城中学、芮城中学2017-2018学年高二上学期期中联考化学试题
2 . 根据所学知识,问答下列问题:
(1)在25℃、101kPa下,已知完全燃烧4.4g丙烷气体,生成 和液态水时,释放222.0kJ热量,
和液态水时,释放222.0kJ热量, 的燃烧热
的燃烧热
___________  。
。
(2)已知:
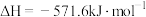 。现有
。现有 和
和 的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中
的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中 和
和 的体积比是
的体积比是___________ 。
(3)一个化学过程的示意图如图。已知甲池的总反应为 。
。

①图中甲池是___________ 装置;A(石墨)电极的名称是___________ 。
②写出通入 的电极的电极反应式:
的电极的电极反应式:___________ 。
③乙池中发生反应的化学方程式为___________ 。当乙池中B(Ag)电极的质量增加5.40g时,甲池中理论上消耗___________ mL(标准状况下) 。
。
(1)在25℃、101kPa下,已知完全燃烧4.4g丙烷气体,生成
 和液态水时,释放222.0kJ热量,
和液态水时,释放222.0kJ热量, 的燃烧热
的燃烧热
 。
。(2)已知:

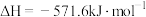 。现有
。现有 和
和 的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中
的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中 和
和 的体积比是
的体积比是(3)一个化学过程的示意图如图。已知甲池的总反应为
 。
。
①图中甲池是
②写出通入
 的电极的电极反应式:
的电极的电极反应式:③乙池中发生反应的化学方程式为
 。
。
您最近一年使用:0次
2024-03-06更新
|
59次组卷
|
2卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题
名校
解题方法
3 . 乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g) CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
②2CH3OH(g) C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
③CH3CH2OH(g) CH3OCH3(g) △H3= +50.7kJ•mol-1
CH3OCH3(g) △H3= +50.7kJ•mol-1
④C2H5OH(g) C2H4(g)+ H2O(g) △H4=akJ•mol-1
C2H4(g)+ H2O(g) △H4=akJ•mol-1
回答下列问题:
(1)a=___________ 。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
①欲提高C2H5OH的平衡转化率,应采取的措施为___________ (填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________ ,平衡时C2H5OH的转化率为_______ (结果保留两位有效数字,下同),该反应的平衡常数K=_________ 。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____ mol,n(C2H5OH)=_____ mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______ ,由此规律推出反应在12h时c(C2H5OH)等于______ mol•L-1
①2CH3OH(g)
 CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1②2CH3OH(g)
 C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1③CH3CH2OH(g)
 CH3OCH3(g) △H3= +50.7kJ•mol-1
CH3OCH3(g) △H3= +50.7kJ•mol-1④C2H5OH(g)
 C2H4(g)+ H2O(g) △H4=akJ•mol-1
C2H4(g)+ H2O(g) △H4=akJ•mol-1回答下列问题:
(1)a=
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(C2H5OH)/(mol•L-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
您最近一年使用:0次
2019-05-06更新
|
87次组卷
|
2卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题
名校
解题方法
4 . 科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
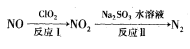
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____ L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____ (填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____ 。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____ ;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____ 。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=
(2)利用氧化氮氧化物的流程如下:
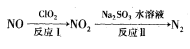
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入
您最近一年使用:0次
名校
5 . 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________ 。
(2)已知在一定温度下:
①C(s)+CO2(g) 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:________ ,△H3=________ (用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是________ 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________ 。
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:
(2)已知在一定温度下:
①C(s)+CO2(g)
 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;③C(s)+H2O(g)
 CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。则K1、K2、K3之间的关系是:
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是
您最近一年使用:0次
名校
解题方法
6 . (1)写出下列物质在水溶液中的电离方程式:
CH3COOH____ HClO4_____
Fe(OH)3____ Ba(OH)2_____
NaHSO4____
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:___ 。
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于___ 。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
CH3COOH
Fe(OH)3
NaHSO4
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
您最近一年使用:0次
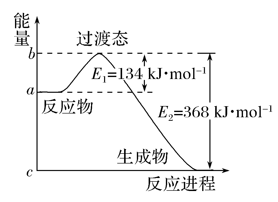
7 . (1)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________ (填“增大”、“减小”或“不变”,下同),ΔH________ 。请写出NO2和CO反应的热化学方程式:________________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ· mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ· mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ· mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为________________________________________________________________ 。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ· mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ· mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ· mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为
您最近一年使用:0次
2017-08-19更新
|
155次组卷
|
3卷引用:山西省天镇县实验中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
8 . 碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____ 。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____ (填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___ KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________ 。
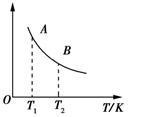
a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____ (填字母)。
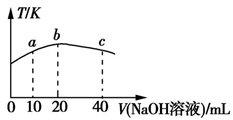
a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g)
 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;CH4(g) + 4NO(g)
 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)
 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
您最近一年使用:0次
名校
解题方法
9 . 请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________ 。
(2)广义的水解观认为:水解的物质和水分别解离成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -b kJ/mol
③ H2O(g)= H2O(l) ΔH3= -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是_________ ,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______ 。
A.HCN B.HClO C.CH3COOH D.H2CO3
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因
(2)广义的水解观认为:水解的物质和水分别解离成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -b kJ/mol
③ H2O(g)= H2O(l) ΔH3= -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是
A.HCN B.HClO C.CH3COOH D.H2CO3
您最近一年使用:0次
10 . I.可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率________ ;v正 ________________ ;
(2)保持容器体积不变,加入He,则HCl的物质的量_______________________ .
(3)保持容器压强不变,加入He,则O2的体积分数______________________ ;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度____________ ,相对分子质量 ______________________ .
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为____________________________________
 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):(1)降低温度,Cl2的转化率
(2)保持容器体积不变,加入He,则HCl的物质的量
(3)保持容器压强不变,加入He,则O2的体积分数
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为
您最近一年使用:0次



