名校
解题方法
1 . I.锂电池有广阔的应用前景。用“循环电沉积”法处理某种锂电池,可使其中的Li电极表面生成只允许Li+通过的Li2CO3和C保护层,工作原理如图1,具体操作如下。
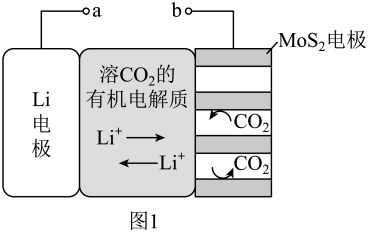
i.将表面洁净的Li电极和MoS2电极浸在溶有CO2的有机电解质溶液中。
ii.0~5min,a端连接电源正极,b端连接电源负极,电解,MoS2电极上生成Li2CO3和C。
iii.5~10min,a端连接电源负极,b端连接电源正极,电解,MoS2电极上消耗Li2CO3和C,Li电极上生成Li2CO3和C。
步骤ii和步骤iii为1个电沉积循环。
iv.重复步骤ii和步骤iii的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的Li+的迁移方向为____ 。
a.由Li电极向MoS2电极迁移 b.由MoS2电极向Li电极迁移
(2)已知下列反应的热化学方程式。
2Li(s)+2CO2(g)=Li2CO3(s)+CO(g) ΔH1=-539kJ•mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172kJ•mol-1
步骤ii电解总反应的热化学方程式为____ 。
(3)步骤iii中,Li电极的电极反应式为____ 。
(4)Li2CO3和C只有在MoS2的催化作用下才能发生步骤iii的电极反应,反应历程中的能量变化如图。下列说法正确的是____ (填字母)。

a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.MoS2催化剂通过降低电极反应的活化能使反应速率增大
II.如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

(5)①腐蚀过程中,负极是____ (填“a”“b”或“c”)。
②环境中的Cl-扩散到孔口,并与正极产物和负极产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_____ 。
③若生成4.29gCu2(OH)3Cl,则理论上消耗氧气的体积为____ L(标准状况)。

i.将表面洁净的Li电极和MoS2电极浸在溶有CO2的有机电解质溶液中。
ii.0~5min,a端连接电源正极,b端连接电源负极,电解,MoS2电极上生成Li2CO3和C。
iii.5~10min,a端连接电源负极,b端连接电源正极,电解,MoS2电极上消耗Li2CO3和C,Li电极上生成Li2CO3和C。
步骤ii和步骤iii为1个电沉积循环。
iv.重复步骤ii和步骤iii的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的Li+的迁移方向为
a.由Li电极向MoS2电极迁移 b.由MoS2电极向Li电极迁移
(2)已知下列反应的热化学方程式。
2Li(s)+2CO2(g)=Li2CO3(s)+CO(g) ΔH1=-539kJ•mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172kJ•mol-1
步骤ii电解总反应的热化学方程式为
(3)步骤iii中,Li电极的电极反应式为
(4)Li2CO3和C只有在MoS2的催化作用下才能发生步骤iii的电极反应,反应历程中的能量变化如图。下列说法正确的是

a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.MoS2催化剂通过降低电极反应的活化能使反应速率增大
II.如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

(5)①腐蚀过程中,负极是
②环境中的Cl-扩散到孔口,并与正极产物和负极产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为
③若生成4.29gCu2(OH)3Cl,则理论上消耗氧气的体积为
您最近一年使用:0次
2022-10-19更新
|
211次组卷
|
2卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
名校
2 . (1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)=ETBE(g) △H。回答下列问题:
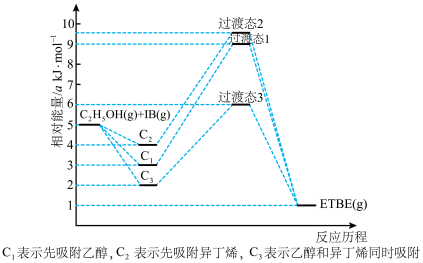
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________ (填C1、C2或C3)。
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
反应ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
反应ⅲ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________ 。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时刻v正___ v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___ 。
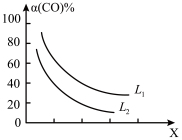
③催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表___ (填“温度”或“压强”),且L1___ L2(填“>”“<”或“=”)。
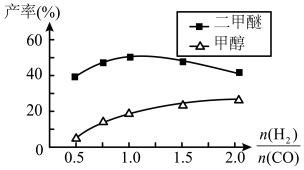
④在催化剂的作用下同时进行三个反应,发现随着起始投料比 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________ 。

反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
反应ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
反应ⅲ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol·L−1) | 0.46 | 1.0 | 1.0 |
③催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表

④在催化剂的作用下同时进行三个反应,发现随着起始投料比
 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
您最近一年使用:0次
2020-05-13更新
|
229次组卷
|
3卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
2011高二上·山东潍坊·学业考试
3 . Ⅰ.北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ/mol
C(s)+O2(g)=CO2(g);ΔH=–393.5kJ/mol
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是_________ 。
⑵根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___________ 。
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ/mol
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:_____________________ 。
Ⅱ.据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol/L的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是_____________ 。
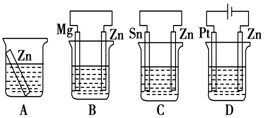
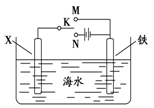
⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于______ 处。若X为锌,开关K置于M处,该电化学防护法称为______________________ 。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ/mol
C(s)+O2(g)=CO2(g);ΔH=–393.5kJ/mol
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是
⑵根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ/mol
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:
Ⅱ.据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol/L的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是

⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于

您最近一年使用:0次



