12-13高三上·湖北孝感·阶段练习
名校
解题方法
1 . 已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-24.8kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47.19kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-24.8kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47.19kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
| A.-218kJ·mol-1 | B.-109kJ·mol-1 | C.109kJ·mol-1 | D.218kJ·mol-1 |
您最近一年使用:0次
2022-07-22更新
|
915次组卷
|
45卷引用:2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学
(已下线)2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学2014-2015学年福建省清流一中高二上学期月考化学理试卷(已下线)2013-2014学年内蒙古赤峰市元宝山区高二上学期期末化学试卷2016-2017学年湖南省衡阳一中高二上10月月考化学卷2016-2017学年广东佛山一中高二上第一次段考化学卷2016-2017学年山西省大同一中高二12月月考化学试卷甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题【市级联考】湖南省娄底市2018-2019学年高二上学期期中考试化学试题云南省麒麟高中2018-2019学年高二6月考试化学试题黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期期中考试化学试题湖南省长沙市雅礼中学2018-2019高二12月月考化学试题四川省威远中学2019-2020学年高二上学期第二次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2019-2020学年高二10月月考化学试题辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 高效手册四川省新津中学2020-2021学年高二10月月考化学试题江西省南昌市八一中学2020-2021学年高二上学期10月考试化学试题四川省叙州区第二中学2020-2021学年高二上第二学月考试化学试题(已下线)作业02 反应热的计算-2021年高二化学暑假作业(人教版2019)(已下线)1.3 化学反应热的计算-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)1.1.2 反应热的测量与计算-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)1.2 反应热的计算(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第1章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.2.2 化学反应焓变的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)安徽省滁州九校2021-2022学年高二上学期期中考试化学试题河南省平顶山市名校联盟2022-2023学年高二上学期开学考试化学试题山东省聊城市第二中学2022-2023学年高二上学期开学考试化学试题(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)四川省德阳市第五中学2022-2023学年高二上学期开学考试化学试题湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题湖北省十堰市县区普通高中联合体2022-2023学年高二上学期11月期中联考化学试题河南省周口市太康县2022-2023学年高二上学期11月期中考试化学试题(已下线)2013届湖北省孝感高中高三9月调研考试化学试卷(已下线)2013届湖北省孝感高中高三9月调研考试化学试卷2014-2015学年河北省正定中学高一下第三次月考化学试卷2016届吉林省长春市第十一高中高三上学期期中测试化学试卷2016届湖南长沙市长郡中学三上学期第四次月考化学试卷内蒙古杭锦后旗奋斗中学2018届高三上学期第二次月考化学试题(已下线)2019年4月8日 《每日一题》三轮复习——反应热的计算与盖斯定律广东省揭阳第一中学2016-2017学年高一下学期第二次阶段考试化学科试题湖北省黄冈市黄梅国际育才高级中学2018-2019学年高一下学期5月月考化学试题辽宁省沈阳市辽宁省实验中学2020届高三上学期期中考试化学试题河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题
名校
解题方法
2 . N2O和CO是环境污染性气体,可在 表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
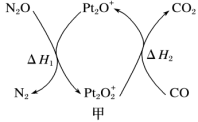
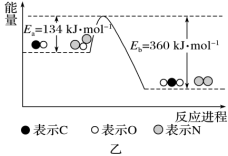
 表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是

A.总反应的 |
B.为了实现转化,需不断向反应器中补充 和 和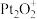 |
| C.该反应正反应的活化能小于逆反应的活化能 |
| D.CO为还原剂 |
您最近一年使用:0次
2022-06-22更新
|
477次组卷
|
11卷引用:福建省莆田第二十五中学2022-2023学年高二上学期期中考试化学试题
福建省莆田第二十五中学2022-2023学年高二上学期期中考试化学试题 福建省龙岩市连城县第一中学2023-2024学年高二上学期10月月考化学试题河南省郑州市巩义,中牟,登封等六县2021-2022学年高二下学期期末联考化学试题(已下线)1.2 反应热的计算-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)广东省佛山市南海区桂城中学2022-2023学年高二上学期第一次段考化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题山西省实验中学2023-2024学年高二上学期第一次月考化学试题新疆乌鲁木齐市高级中学2023-2024学年高二上学期第一次月考化学试题宁夏银川市贺兰县第一中学2023-2024学年高二上学期第一阶段考试化学试题广东省茂名市化州市第一中学2023-2024学年高二上学期期中测评化学试题
3 . 已知:2H2(g)+O2(g)=2H2O(g) ΔH1
3H2(g)+ Fe2O3(s)=2Fe(s)+ 3H2O(g) ΔH2
2Fe(s)+ 1.5O2(g)=Fe2O3(s) ΔH3
2Al(s)+ 1.5O2(g)=A12O3(S) ΔH4
2Al(s)+ Fe2O3(s)=Al2O3(s)+ 2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
3H2(g)+ Fe2O3(s)=2Fe(s)+ 3H2O(g) ΔH2
2Fe(s)+ 1.5O2(g)=Fe2O3(s) ΔH3
2Al(s)+ 1.5O2(g)=A12O3(S) ΔH4
2Al(s)+ Fe2O3(s)=Al2O3(s)+ 2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
| A.ΔH1<0,ΔH3>0 | B.ΔH5<0,ΔH4<ΔH3 |
| C.ΔH1=ΔH2+ΔH3 | D.ΔH3=ΔH4+ΔH5 |
您最近一年使用:0次
2022-05-10更新
|
3305次组卷
|
53卷引用:【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题
【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题福建省福州市八县(市、区)一中2021-2022学年高二上学期期中联考化学试题2015-2016学年陕西西藏民族学院附中高二下期末化学卷四川省成都石室中学2017-2018学年高二10月月考化学试题重庆市南开中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二上学期期中考试模拟化学试题湖南省儋州一中2018-2019学年高二上学期第一次月考化学试题【校级联考】浙江省“温州十五校联合体”2018-2019学年高二下学期期中考试化学试题湖南省衡阳市第一中学2019-2020学年高二上学期第一次月考化学试题江西省赣州市寻乌中学2019-2020学年高二上学期第二次段考化学试题(已下线)1.2.1 盖斯定律(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)1.3.2 反应热的计算(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第一章 化学反应与能量(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)江苏省无锡市普通高中2018-2019学年高二下学期期末质量调研化学试题广东省揭阳市揭东区2021-2022学年高二上学期期末考试化学试题(已下线)化学反应的热效应——进阶学习(已下线)1.2 反应热的计算-同步学习必备知识江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题吉林省九台龙成实验学校2022-2023学年高二上学期第一次月考化学试题作业(三) 反应焓变的计算宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题四川省什邡中学2023-2024学年高二上学期10月月考化学试题新疆乌鲁木齐市第八中学2023-2024学年高二上学期期中考试化学试题2015届江苏省连云港等四市高三一模化学试卷2016届江苏省泰州中学高三上学期第二次质检化学试卷2016届黑龙江省大庆一中高三下开学考试理综化学试卷2016届江西省宜春市丰城中学高三上学期第四次月考化学试卷2015-2016学年黑龙江大庆市铁人中学高一下期中化学试卷2017届黑龙江省哈尔滨六中高三上9月月考化学试卷黑龙江省青冈县一中2016-2017学年高一下学期期末考试化学试题(已下线)2018年9月16日 《每日一题》一轮复习- 每周一测(已下线)2019年9月11日《每日一题》2020年一轮复习—— 反应热的计算人教版高中化学必修2第二章《化学反应与能量》测试题2019-2020学年人教版高中化学高考基础复习专题8《水溶液中的离子平衡》测试卷【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】(已下线)专题6.1 化学能与热能(讲)——2020年高考化学一轮复习讲练测辽宁省瓦房店市高级中学2019-2020学年高一下学期期末考试化学试题辽宁师范大学附属中学2018-2019学年高一下学期期末考试化学试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第15讲 化学反应的热效应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向18 化学反应与能量变化-备战2022年高考化学一轮复习考点微专题(已下线)第14周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广东省广州市广东华侨中学2021-2022学年高一下学期期中考试化学试题江苏省南京市金陵中学2021-2022学年高一下学期6月月考化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题十 化学能与热能-实战高考·二轮复习核心突破(已下线)专题15 反应热计算的几种类型-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第2讲 盖斯定律 反应热的计算
名校
4 . 在T℃, 气体通过铁管时,发生腐蚀反应(X):
气体通过铁管时,发生腐蚀反应(X):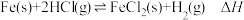 (K=0.33),下列分析不正确的是
(K=0.33),下列分析不正确的是
 气体通过铁管时,发生腐蚀反应(X):
气体通过铁管时,发生腐蚀反应(X):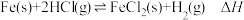 (K=0.33),下列分析不正确的是
(K=0.33),下列分析不正确的是| A.降低反应温度,可减缓反应X的速率 |
B.在 气体中加入一定量 气体中加入一定量 能起到防护铁管的作用 能起到防护铁管的作用 |
C.反应X的 可通过如下反应获得: 可通过如下反应获得: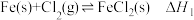 、 、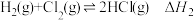 |
D.T℃时,若气体混合物中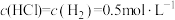 ,铁管被腐蚀 ,铁管被腐蚀 |
您最近一年使用:0次
2022-04-01更新
|
1072次组卷
|
13卷引用:福建省厦门第一中学2022-2023学年高二上学期期中考试化学试题
福建省厦门第一中学2022-2023学年高二上学期期中考试化学试题福建省龙岩第一中学2022-2023学年高二上学期第三次月考化学试题山东省青岛第二中学2022-2023学年高二上学期期中考试化学试题山东省滕州市第一中学2023-2024学年高二上学期10月月考化学试题辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题北京市第一○一中学2023-2024学年高二上学期统练一化学试题北京市中关村中学2023-2024学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2023-2024学年高二上学期期中考试化学试题北京市朝阳区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)(已下线)化学-2022年高考考前押题密卷(广东卷)湖南省娄底市第五中学2021-2022学年高三下学期第三次模拟考试化学试题北京一零一中学2022-2023学年高三上学期统练六化学试题
5 . 下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应不必加热就一定能发生 |
C.同温同压下, 在光照和点燃条件的 在光照和点燃条件的 不同 不同 |
| D.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
您最近一年使用:0次
2022-03-20更新
|
146次组卷
|
2卷引用:福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题
6 . 已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示。
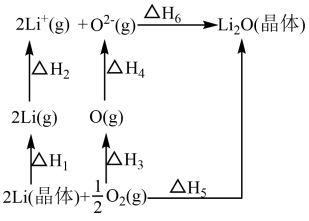
下列说法正确的是

下列说法正确的是
| A.ΔH1>0,ΔH2<0 |
| B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH6-ΔH5=0 |
| C.ΔH3<0,ΔH4<0 |
| D.ΔH1+ΔH2+ΔH3+ΔH4=ΔH5+ΔH6 |
您最近一年使用:0次
2022-03-17更新
|
1731次组卷
|
7卷引用:福建省华安县第一中学2023-2024学年高二上学期10月月考化学试题
7 . 依据图示关系, 等于
等于
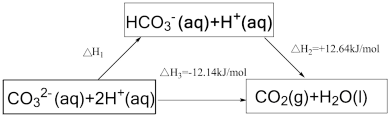
 等于
等于
A.+0.5 | B.-0.5 | C.+24.78 | D.-24.78 |
您最近一年使用:0次
2022-01-23更新
|
312次组卷
|
4卷引用:福建省福清市高中联合体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 向 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是

 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
A.反应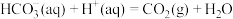 (1)为放热反应 (1)为放热反应 |
B. |
C.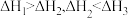 |
D. (1),若使用催化剂,则 (1),若使用催化剂,则 变小 变小 |
您最近一年使用:0次
2021-12-21更新
|
857次组卷
|
26卷引用:福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题
福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题宁夏银川一中2017-2018学年高二上学期第二次月考理综化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题(共建部)安徽省滁州市定远县炉桥中学2019-2020学年高二上学期第一次检测化学试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(理)试题湖南省衡阳市第八中学2019-2020学年高二下学期期中考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题江西省彭泽县第一中学2020-2021学年高二上学期第一次月考化学试题江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题辽宁省庄河市高级中学2021-2022学年高二上学期开学考试化学试题浙江省温州市2021-2022学年高二上学期12月普通高中学考适应性测试化学试题新疆乌鲁木齐第四中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题山东省实验中学2022-2023学年高二上学期10月月考化学试题浙江省北斗星盟2023-2024学年高二上学期12月月考化学试题2017届天津市五区县高三上学期期末考试化学试卷天津市五区县2017届高三上学期期末考试化学试卷天津市2018届高三第二学期高考模拟化学试题山东省潍坊市2019-2020学年高一下学期4月阶段考试化学试题安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题黑龙江省八校2021届高三摸底考试化学试题新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题湖南省常德市鼎城一中2022-2023学年高三第五次月考化学试题
9 . 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是
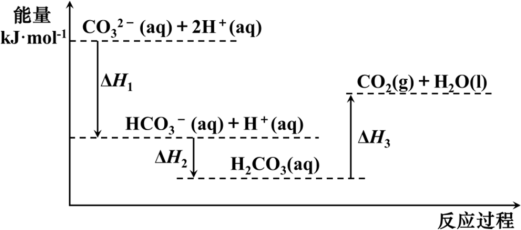

A.反应 (aq)+2H+(aq) = CO2(g)+H2O(l)为放热反应 (aq)+2H+(aq) = CO2(g)+H2O(l)为放热反应 |
| B.ΔH1>ΔH3>ΔH2 |
C. (aq)+H+(aq)=CO2(g)+H2O(l) ΔH = ΔH2—ΔH3 (aq)+H+(aq)=CO2(g)+H2O(l) ΔH = ΔH2—ΔH3 |
| D.H2CO3(aq)=CO2(g)+H2O(l) ΔH3 <0 |
您最近一年使用:0次
2021-12-06更新
|
361次组卷
|
4卷引用:福建省宁德市同心顺联盟校2021—2022学年高二上学期期中联考化学试题
解题方法
10 . 已知热化学方程式:①H2(g) +  O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,
O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,
②H2(g) + O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是
O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是
 O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,
O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,②H2(g) +
 O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是
O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是| A.2H2(g) + O2(g) = 2H2O △H = -527.6 kJ∙mol-1 |
| B.H2O(g) = H2O(l) △H = +44 kJ∙mol-1 |
| C.①表示在298K时,由1mol H2(g)和0.5mol O2(g)反应生成1mol H2O(l)放出285.8kJ热量 |
D.②表示在298K时,1分子氢气和 分子氧气反应生成1 分子水蒸气放出241.8kJ热量 分子氧气反应生成1 分子水蒸气放出241.8kJ热量 |
您最近一年使用:0次
2021-12-06更新
|
143次组卷
|
2卷引用:福建省宁德市同心顺联盟校2021—2022学年高二上学期期中联考化学试题



