1 . 根据已知,回答下列问题。
(1)在 、
、 下,
下, 甲烷燃烧生成
甲烷燃烧生成 和液态水时放热
和液态水时放热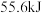 。则表示甲烷燃烧热的热化学方程式为
。则表示甲烷燃烧热的热化学方程式为______ 。
(2)常温常压下,断裂 (理想)气体分子化学键所吸收的能量或形成
(理想)气体分子化学键所吸收的能量或形成 (理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数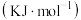
根据键能数据计算以下反应的反应热: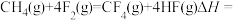
______ 。
(3)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.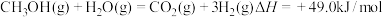
B.
由上述方程式可知, 的燃烧热
的燃烧热______ (填“大于”、“等于”或“小于”)
(4)火箭的常规燃料是液态四氧化二氮和液态肼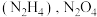 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:


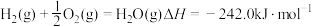
请写出肼和氟气反应的热化学方程式:______ 。
(1)在
 、
、 下,
下, 甲烷燃烧生成
甲烷燃烧生成 和液态水时放热
和液态水时放热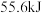 。则表示甲烷燃烧热的热化学方程式为
。则表示甲烷燃烧热的热化学方程式为(2)常温常压下,断裂
 (理想)气体分子化学键所吸收的能量或形成
(理想)气体分子化学键所吸收的能量或形成 (理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C-H | 414 | C-F | 489 | H-F | 565 |
| 436 |
| 391 |
| 158 |
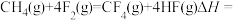
(3)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.
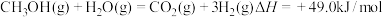
B.

由上述方程式可知,
 的燃烧热
的燃烧热
(4)火箭的常规燃料是液态四氧化二氮和液态肼
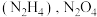 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。已知:


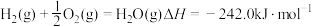
请写出肼和氟气反应的热化学方程式:
您最近一年使用:0次
解题方法
2 . I.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

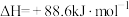
则M、N相比,较稳定的是___________ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,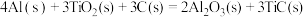
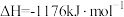 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为___________ kJ。
(3) 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①
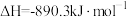 ;
;
②
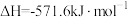 ;
;
③
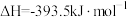 ;
;
已知 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比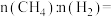 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为___________ kJ; 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
___________  。
。
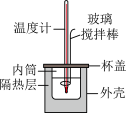
II. 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用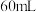
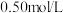 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热___________ (填“相等”或“不相等”)。
(5)下列说法正确的是___________(填字母)。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

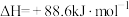
则M、N相比,较稳定的是
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
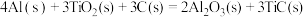
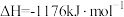 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为(3)
 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为①

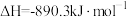 ;
;②

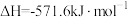 ;
;③

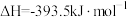 ;
;已知
 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比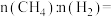 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
 。
。II.
 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用
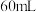
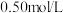 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热(5)下列说法正确的是___________(填字母)。
| A.玻璃搅拌棒可用铜丝搅拌棒替代 |
| B.向内筒中加入稀碱时,应当缓慢而匀速地加入 |
| C.实验中如果用相同体积、相同浓度的醋酸代替盐酸,测得的中和热数值将偏小 |
| D.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差 |
您最近一年使用:0次
名校
解题方法
3 . 研究化学反应中的能量变化对生产、生活有重要的意义。
(1)甲烷是一种高效清洁的新能源, 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为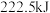 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)已知:


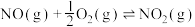


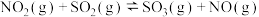


则
___________ (填含 、
、 的表达式),
的表达式),
___________ (填含 、
、 的表达式)。
的表达式)。
(3)已知: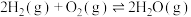
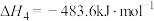 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:
①合成氨反应 的活化能
的活化能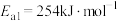 ,则氨分解反应
,则氨分解反应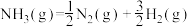 的活化能
的活化能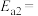
___________  。
。
②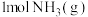 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出___________ kJ的热量;又已知
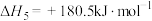 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为___________ 。
(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

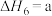
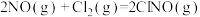
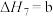
则反应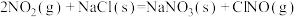 的
的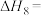
___________ (用含a、b的表达式表示)。
(1)甲烷是一种高效清洁的新能源,
 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为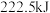 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)已知:



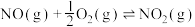


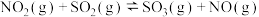


则

 、
、 的表达式),
的表达式),
 、
、 的表达式)。
的表达式)。(3)已知:
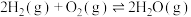
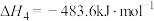 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:| 化学键 | H—H |  | N—H |
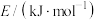 | 436 | 946 | 391 |
 的活化能
的活化能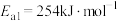 ,则氨分解反应
,则氨分解反应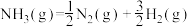 的活化能
的活化能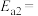
 。
。②
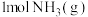 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出
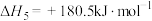 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

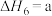
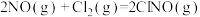
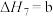
则反应
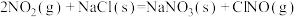 的
的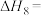
您最近一年使用:0次
2023-11-13更新
|
210次组卷
|
2卷引用:福建省泉州市2023-2024学年高二上学期期中考试化学试题
4 . 化学反应过程伴随有热量的变化。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:
反应Ⅱ: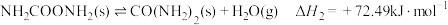
总反应: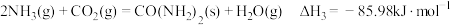
则反应I的
___________  。
。
(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
则

___________ 。(用a、b、c、d表示)
②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
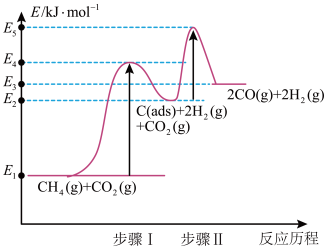
步骤1反应的焓变 为
为___________ kJ/mol(选用E1~E5的关系式表示)。
③反应 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
___________  (填“>”或“<)。
(填“>”或“<)。
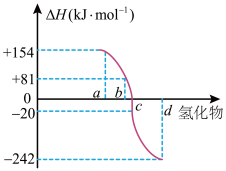
(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热( )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为___________ 。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:

反应Ⅱ:
总反应:
则反应I的

 。
。(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
| 化学键 | H—H | C=C | C—C | C—H |
| E(kJ/mol) | a | b | c | d |


②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤1反应的焓变
 为
为③反应
 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
 (填“>”或“<)。
(填“>”或“<)。(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(
 )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为
您最近一年使用:0次
5 . 化学反应原理对化学反应的研究具有指导意义。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
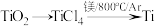
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______ 。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2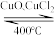 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.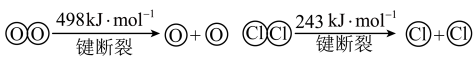
(2)写出该条件下,反应A的热化学方程式为_______ 。
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为_______ kJ。
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
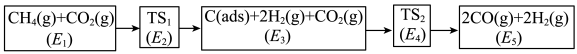
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的 可表示为
可表示为_______ kJ·mol-1。
(5)若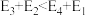 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为_______ 。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
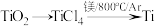
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
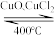 2Cl2+2H2O
2Cl2+2H2O已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.
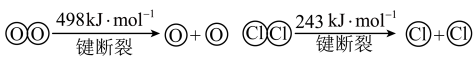
(2)写出该条件下,反应A的热化学方程式为
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
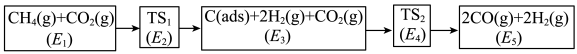
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的
 可表示为
可表示为(5)若
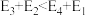 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为
您最近一年使用:0次
6 . 利用 制甲醇具有重要意义。其过程可能发生的反应如下:
制甲醇具有重要意义。其过程可能发生的反应如下:
反应1: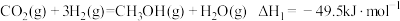
反应2:
反应3: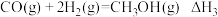
(1)
_______ 
(2)恒容条件下,下列有利于提高 平衡产率的条件是_______。
平衡产率的条件是_______。
(3)控制一定压强,通入 和
和 ,反应
,反应 后,
后, 转化率
转化率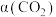 、
、 产率
产率 及
及 产率
产率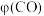 随温度变化曲线如图。
随温度变化曲线如图。
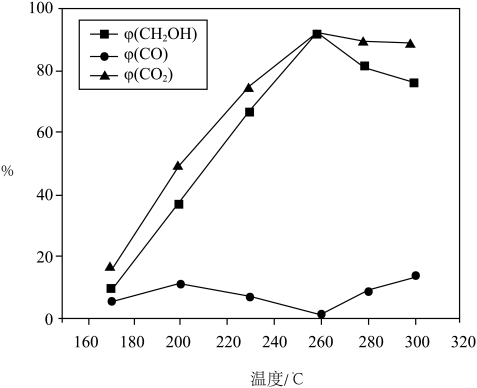
①温度升高, 先升高后降低的原因是
先升高后降低的原因是_______ 。
②260℃时,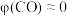 (认为此时只发生反应1),
(认为此时只发生反应1),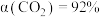 ,气体总体积为
,气体总体积为 ,则该温度下反应1的平衡常数
,则该温度下反应1的平衡常数
_______ (列出代数式即可),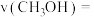
_______ (列出代数式即可)。
③280℃时, ,
, ,则反应2的平衡常数
,则反应2的平衡常数
_______ (列出代数式即可)。
(4)学界关于反应2产生的 能否发生反应3存在争议。科学家利用
能否发生反应3存在争议。科学家利用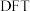 模拟
模拟 催化剂表面合成
催化剂表面合成 的两种不同路径,其决速步及活化能
的两种不同路径,其决速步及活化能 分别如下。
分别如下。
路径1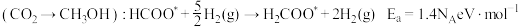
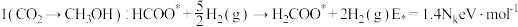 路径2
路径2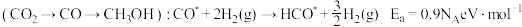
由此分析,200~260℃时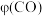 降低的原因是
降低的原因是_______ 。
 制甲醇具有重要意义。其过程可能发生的反应如下:
制甲醇具有重要意义。其过程可能发生的反应如下:反应1:
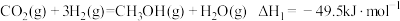
反应2:

反应3:
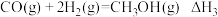
(1)


(2)恒容条件下,下列有利于提高
 平衡产率的条件是_______。
平衡产率的条件是_______。| A.使用催化剂 | B.调整 和 和 的投料比由1∶1至1∶3 的投料比由1∶1至1∶3 |
| C.增大反应物总压 | D.通入稀有气体 |
 和
和 ,反应
,反应 后,
后, 转化率
转化率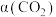 、
、 产率
产率 及
及 产率
产率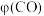 随温度变化曲线如图。
随温度变化曲线如图。
①温度升高,
 先升高后降低的原因是
先升高后降低的原因是②260℃时,
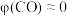 (认为此时只发生反应1),
(认为此时只发生反应1),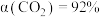 ,气体总体积为
,气体总体积为 ,则该温度下反应1的平衡常数
,则该温度下反应1的平衡常数
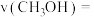
③280℃时,
 ,
, ,则反应2的平衡常数
,则反应2的平衡常数
(4)学界关于反应2产生的
 能否发生反应3存在争议。科学家利用
能否发生反应3存在争议。科学家利用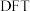 模拟
模拟 催化剂表面合成
催化剂表面合成 的两种不同路径,其决速步及活化能
的两种不同路径,其决速步及活化能 分别如下。
分别如下。路径1
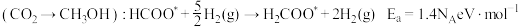
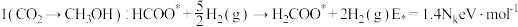 路径2
路径2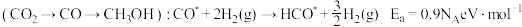
由此分析,200~260℃时
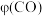 降低的原因是
降低的原因是
您最近一年使用:0次
7 . 化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,1g甲醇 在氧气中充分燃烧生成二氧化碳和液态水释放出
在氧气中充分燃烧生成二氧化碳和液态水释放出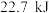 的热量,写出甲醇燃烧的热化学方程式
的热量,写出甲醇燃烧的热化学方程式_______ 。
(2)已知反应CH3-CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
试计算该反应的反应热
_______ 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变
_______ 。
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
(4)根据能量变化示意图:
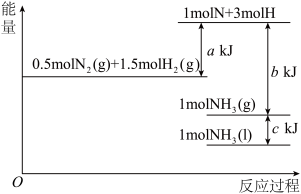
写出N2(g)+3H2(g)=2NH3(l)
_______ 
(1)实验测得,1g甲醇
 在氧气中充分燃烧生成二氧化碳和液态水释放出
在氧气中充分燃烧生成二氧化碳和液态水释放出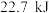 的热量,写出甲醇燃烧的热化学方程式
的热量,写出甲醇燃烧的热化学方程式(2)已知反应CH3-CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C-H |  | 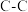 | H-H | |
键能 | 414.4 | 615.3 | 347.3 | 435.3 |

(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变

①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+
 O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1(4)根据能量变化示意图:

写出N2(g)+3H2(g)=2NH3(l)


您最近一年使用:0次
解题方法
8 . 填空。
(1)25℃、101KPa时,26gC2H2气体完全燃烧生成二氧化碳气体和液态水放出1299.6kJ的热,写出该反应的热化学方程式_______ 。
(2)研究NO2、SO2等大气污染气体的处理方法具有重要的意义。
已知:①2SO2(g)+O2(g)⇌2SO3(g) ∆H1=-196kJ∙mol-1
②2NO(g)+O2(g)⇌2NO2(g) ∆H2=-113.0kJ∙mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的∆H=_______ kJ∙mol-1。
(3)已知拆开1mol下列气态分子形成独立的气态原子时需要的能量数据如表。
则N2(g)+O2(g)=2NO(g) ΔH=_______ kJ·mol-1。
(1)25℃、101KPa时,26gC2H2气体完全燃烧生成二氧化碳气体和液态水放出1299.6kJ的热,写出该反应的热化学方程式
(2)研究NO2、SO2等大气污染气体的处理方法具有重要的意义。
已知:①2SO2(g)+O2(g)⇌2SO3(g) ∆H1=-196kJ∙mol-1
②2NO(g)+O2(g)⇌2NO2(g) ∆H2=-113.0kJ∙mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的∆H=
(3)已知拆开1mol下列气态分子形成独立的气态原子时需要的能量数据如表。
| 物质 | N2 | O2 | NO |
| 能量(kJ·mol-1) | 946 | 498 | 632 |
您最近一年使用:0次
名校
解题方法
9 . 用CO与H2反应合成甲醇符合原子经济的绿色化学理念,反应过程中能量变化如图所示。
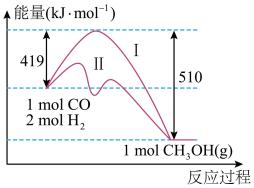
(1)请写出CO与H2反应合成甲醇的热化学方程式_______ ;
(2)该反应中相关的化学键键能数据如表所示:则C≡O中的键能为_______ kJ/mol;
(3)图中曲线I和II所对应的反应路径,比较容易发生的是_______ (填I或II);
(4)已知:①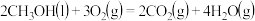
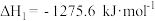 ,
,
②
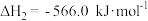 ,
,
③
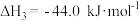 ,
,
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(5)一定条件下,1 g甲醇蒸气完全燃烧生成二氧化碳和液态水,放出Q kJ的热量。则表示甲醇燃烧热的热化学方程式为_______ 。

(1)请写出CO与H2反应合成甲醇的热化学方程式
(2)该反应中相关的化学键键能数据如表所示:则C≡O中的键能为
| 化学键 | H-H | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 465 | 413 |
(3)图中曲线I和II所对应的反应路径,比较容易发生的是
(4)已知:①
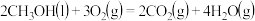
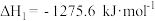 ,
,②

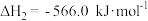 ,
,③

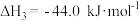 ,
,写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)一定条件下,1 g甲醇蒸气完全燃烧生成二氧化碳和液态水,放出Q kJ的热量。则表示甲醇燃烧热的热化学方程式为
您最近一年使用:0次
10 . 甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:
①

②

③

(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
由此计算
_______  ;已知
;已知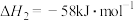 ,则
,则
_______  。
。
(2)已知在常温常压下:
①
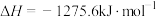
②
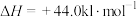
写出表示甲醇燃烧热的热化学方程式_______ 。
(3)已知常温时红磷比白磷稳定,已知:
① (白磷,s)
(白磷,s)

②4P(红磷,s)

比较反应中 的大小:
的大小:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)人体内葡萄糖的消耗可用下列热化学方程式表示:
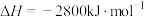 ;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为
;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为_______ 。
 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:①


②


③


(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
E/ | 436 | 343 | 1076 | 465 | 413 |

 ;已知
;已知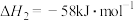 ,则
,则
 。
。(2)已知在常温常压下:
①

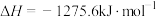
②

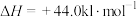
写出表示甲醇燃烧热的热化学方程式
(3)已知常温时红磷比白磷稳定,已知:
①
 (白磷,s)
(白磷,s)

②4P(红磷,s)


比较反应中
 的大小:
的大小:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)人体内葡萄糖的消耗可用下列热化学方程式表示:

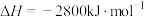 ;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为
;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为
您最近一年使用:0次






