1 . 回答下列问题
(1)下列变化过程属于放热反应的是_________ 。
①2Al + Fe2O3 2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
(2)CaCO3(s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
则ΔH1_______ ΔH2(填“>”、“<”或“=”)。
(3)已知1g苯燃烧生成二氧化碳和气态水时放出a kJ热量,1mol液态水气化需要吸收b kJ热量,请写出苯的燃烧热的热化学方程__________________ 。
(4)让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g) + O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=
O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=  S2(g) + 2H2O(g) ΔH2
S2(g) + 2H2O(g) ΔH2
③H2S(g) + O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4
O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4
则ΔH4的表达式为________________ 。
(5)CO(g)和CH3OH(l)的摩尔燃烧焓ΔH分别为a kJ·mol-1和b kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和1mol液态水的ΔH=__________ 。
(6)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4—CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①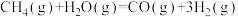
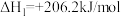
②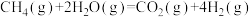
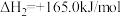
写出该催化重整反应的热化学方程式:_____________ 。
(1)下列变化过程属于放热反应的是
①2Al + Fe2O3
 2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌(2)CaCO3(s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
则ΔH1
(3)已知1g苯燃烧生成二氧化碳和气态水时放出a kJ热量,1mol液态水气化需要吸收b kJ热量,请写出苯的燃烧热的热化学方程
(4)让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g) +
 O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=
O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=  S2(g) + 2H2O(g) ΔH2
S2(g) + 2H2O(g) ΔH2③H2S(g) +
 O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4
O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4则ΔH4的表达式为
(5)CO(g)和CH3OH(l)的摩尔燃烧焓ΔH分别为a kJ·mol-1和b kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和1mol液态水的ΔH=
(6)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4—CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①
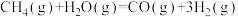
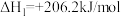
②
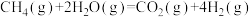
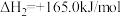
写出该催化重整反应的热化学方程式:
您最近一年使用:0次
2 . 碳及其化合物在生产、生活中广泛存在。请回答下列问题:
(1)已知某温度下某反应 的化学平衡常数表达式为 K=
的化学平衡常数表达式为 K=_______ 。
(2)已知在一定温度下,
①
 平衡常数
平衡常数
②
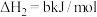 平衡常数
平衡常数
③
 平衡常数
平衡常数
则 、
、 、
、 之间的关系是
之间的关系是
_______ ,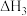 =
=_______  用含a、b的代数式表示
用含a、b的代数式表示 。
。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: ;该反应平衡常数随温度的变化如表所示:
;该反应平衡常数随温度的变化如表所示:
该反应的正反应方向是_______ 反应 填“吸热”或“放热”
填“吸热”或“放热” ,若在500℃时进行,设起始时CO和H2O起始浓度均为0.02mol/L,在该条件下,CO的平衡转化率为
,若在500℃时进行,设起始时CO和H2O起始浓度均为0.02mol/L,在该条件下,CO的平衡转化率为_______ 。
(4)电化学法还原二氧化碳为乙烯原理如下图所示。

A为电源的_______ 极(填“正”或“负”),阴极电极反应式为_______ 。电路中转移0.2 mol 电子,理论上产生氧气_______ L(标准状况)。
(1)已知某温度下某反应
 的化学平衡常数表达式为 K=
的化学平衡常数表达式为 K=(2)已知在一定温度下,
①

 平衡常数
平衡常数
②

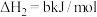 平衡常数
平衡常数
③

 平衡常数
平衡常数
则
 、
、 、
、 之间的关系是
之间的关系是
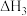 =
= 用含a、b的代数式表示
用含a、b的代数式表示 。
。(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:
 ;该反应平衡常数随温度的变化如表所示:
;该反应平衡常数随温度的变化如表所示:温度 | 400 | 500 | 800 |
| 平衡常数K |  | 9 | 1 |
 填“吸热”或“放热”
填“吸热”或“放热” ,若在500℃时进行,设起始时CO和H2O起始浓度均为0.02mol/L,在该条件下,CO的平衡转化率为
,若在500℃时进行,设起始时CO和H2O起始浓度均为0.02mol/L,在该条件下,CO的平衡转化率为(4)电化学法还原二氧化碳为乙烯原理如下图所示。

A为电源的
您最近一年使用:0次
名校
解题方法
3 . 按要求完成下列热化学方程式:
(1)汽车尾气中的主要污染物是NO和CO,已知:
I 2CO(g)+O2(g) = 2CO2(g) ΔH 1= -566.0kJ•mol-1
II 2NO(g) = N2(g)+O2(g) ΔH 2= -180.8kJ•mol-1;
则将汽车尾气处理成无毒无害产物的热化学方程式为___________ 。
(2)最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图,已知298K时断裂1molN≡N键吸收942 kJ热量,生成1molN-N放出167 kJ热量。根据以上信息和数据,则由气态N2生成1 mol气态N4的的热化学方程式为___________ 。

(1)汽车尾气中的主要污染物是NO和CO,已知:
I 2CO(g)+O2(g) = 2CO2(g) ΔH 1= -566.0kJ•mol-1
II 2NO(g) = N2(g)+O2(g) ΔH 2= -180.8kJ•mol-1;
则将汽车尾气处理成无毒无害产物的热化学方程式为
(2)最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图,已知298K时断裂1molN≡N键吸收942 kJ热量,生成1molN-N放出167 kJ热量。根据以上信息和数据,则由气态N2生成1 mol气态N4的的热化学方程式为

您最近一年使用:0次
4 . 实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷,石墨,氢气燃烧的反应热:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
C(石墨,s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
H2(g)+ O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=
O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=___ 。
C(石墨,s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
H2(g)+
 O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=
O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=
您最近一年使用:0次
名校
解题方法
5 . (1)下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
反应2H2(g)+O2(g)=2H2O(g)是__ (填“吸热”或“放热”)反应,这说明2molH2(g)和1mol O2(g)具有的能量比2mol H2O(g)具有的能量__ (填“高”或“低”)。
(2)氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
已知:N2(g)+O2(g)=2NO(g) △H1 =+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=﹣393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=﹣221 kJ/mol
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___ 。
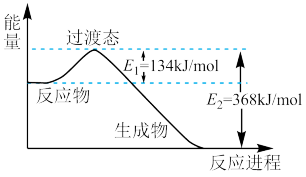
(3)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,已知图中E1=134kJ·mol-1、E2=368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是__ (填“增大”“减小”或“不变”,下同),ΔH的变化是__ 。请写出NO2和CO反应的热化学方程式:__ 。

(4)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:__ 。
| 物质 | H2(g) | O2(g) | H2O(g) |
| 能量 | 436 | 496 | 926 |
(2)氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
已知:N2(g)+O2(g)=2NO(g) △H1 =+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=﹣393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=﹣221 kJ/mol
若某反应的平衡常数表达式为:K=
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(3)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,已知图中E1=134kJ·mol-1、E2=368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是

(4)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:
您最近一年使用:0次
6 . 碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
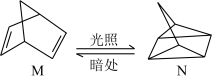 ΔH=+88.6kJ·mol-1。
ΔH=+88.6kJ·mol-1。
则M、N相比,较稳定的是_____ 。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+ O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a
O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a________ 726.5(填“>”“<”或“=”)。
(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________ 。
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:


①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________ (填“增大”“减小”或“不变”,下同),ΔH的变化是________ 。NO2和CO反应的热化学方程式为________ 。
②下表所示是部分化学键的键能参数:
已知P4(g)+5O2(g)=P4O10(g) ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________ (用含a、b、c、d的代数式表示)。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6kJ·mol-1。
ΔH=+88.6kJ·mol-1。则M、N相比,较稳定的是
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+
 O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a
O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:


①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是
②下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | a | b | C | x |
您最近一年使用:0次
名校
7 . (1)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2gSiH4自燃放出热量89.2kJ,其热化学方程式为:___________ 。
(2)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式____________ 。
(2)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式
您最近一年使用:0次
名校
解题方法
8 . (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__ 。
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H=__ 。

(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H=
您最近一年使用:0次
9 . (1)实验测得16 g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧的热化学方程式:_____________ 。
(2)合成氨反应N(g)+3H2(g) 2NH3(g) △H=a kJ·mol-1,能量变化如图所示:
2NH3(g) △H=a kJ·mol-1,能量变化如图所示:

①该反应通常用铁作催化剂,加催化剂会使图中E__ (填“变大”“变小”或“不变”,下同),图中△H___ 。
②有关键能数据如下:
试根据表中所列键能数据计算a为_______ 。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氯为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H1=a kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=b kJ·mol-1
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:_______ 。
(2)合成氨反应N(g)+3H2(g)
 2NH3(g) △H=a kJ·mol-1,能量变化如图所示:
2NH3(g) △H=a kJ·mol-1,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中E
②有关键能数据如下:
| 化学键 | H—H | N—H | N≡N |
| 键能(kJ‧mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a为
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氯为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H1=a kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=b kJ·mol-1
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:
您最近一年使用:0次
2020-08-04更新
|
1040次组卷
|
9卷引用:福建省厦门集美中学2022-2023学年高二上学期第一次月考(10月)化学试题
福建省厦门集美中学2022-2023学年高二上学期第一次月考(10月)化学试题福建省福鼎市第一中学2023-2024学年高二上学期9月月考化学试题江苏省徐州市2019-2020学年高二下学期期中抽测化学试题(已下线)第01章 化学反应与能量(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)辽宁省锦州市义县高级中学2020-2021学年高二10月月考化学试题吉林油田第十一中学2020-2021学年高二上学期期中考试化学试题(已下线)专题1 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河北省元氏县第四中学2021-2022学年高一下学期期末考试化学试题山西省怀仁市第九中学高中部2022-2023学年高一下学期7月期末考试化学试题
解题方法
10 . (1)已知2molH2完全燃烧生成水蒸气放出热量484kJ,且1molH-H键断裂时吸收热量为436kJ,1molO=O键断裂时吸收热量为496kJ,则水蒸气中1molH-O键形成时放出的热量为_____ 。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________ 。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
您最近一年使用:0次



