名校
解题方法
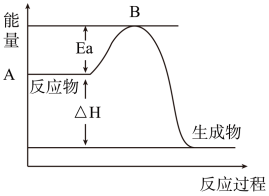
1 . Ⅰ.2SO2(g)+O2(g)⇌2SO3(g)△H=a kJ•mol﹣1,反应过程的能量变化如图所示.已知1molSO2(g)完全转化为1molSO3(g)放热99kJ.请回答:
(1)a=__ kJ•mol﹣1.
(2)Ea的大小对该反应的△H___ (填“有”或“无”)影响.该反应常用V2O5作催化剂,加入V2O5会使图中B点__ (填“升高”、“降低”或“不变”).
(3)已知单质硫的燃烧热为296kJ•mol﹣1,写出反应的热化学方程式:____ .
Ⅱ.(1)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是______________ .
(2)由盖斯定律结合下述反应方程式,回答问题:
(1)已知:①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)
(1)a=
(2)Ea的大小对该反应的△H
(3)已知单质硫的燃烧热为296kJ•mol﹣1,写出反应的热化学方程式:

Ⅱ.(1)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是
(2)由盖斯定律结合下述反应方程式,回答问题:
(1)已知:①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
您最近一年使用:0次
2 . 氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为________________
②该反应的热化学方程式为_____________________
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=____________ kJ·mol-1。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为
②该反应的热化学方程式为
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=
您最近一年使用:0次
2018-10-02更新
|
274次组卷
|
4卷引用:【全国百强校】宁夏回族自治区育才中学2018-2019学年高二上学期第一次(9月)月考化学试题
名校
3 . 在密闭恒温体积为V L的容器中充入2molCO和l0molH2O混合达到平衡时剩余0.5molCO。CO (g)+H2O(g)  CO2(g) +H2(g)。计算:
CO2(g) +H2(g)。计算:
(1)H2O的平衡转化率。
(2)该温度下的化学平衡常数。
(3)恒温条件下,若在该容器中再充入1.5molCO与1.5mol H2,则平衡如何移动?
 CO2(g) +H2(g)。计算:
CO2(g) +H2(g)。计算:(1)H2O的平衡转化率。
(2)该温度下的化学平衡常数。
(3)恒温条件下,若在该容器中再充入1.5molCO与1.5mol H2,则平衡如何移动?
您最近一年使用:0次
名校
4 . 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
(1)按要求完成填空
a.2HCl(g) = H2(g)+Cl2(g);△H=______________________
b.N2 (g)+3H2(g)= 2NH3(g) ΔH=-92kJ/mol,则N—H键的键能是__________ kJ·mol
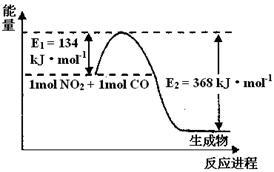
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式__________________________________
(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=CO(g)+ 2H2O(l)ΔH =__________ (用含ΔH1、ΔH2、ΔH3的式子表示)
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H=-1644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H=-815.88kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________ 。
| 化学键 | Cl-Cl | H—H | H—Cl | N≡N |
| 键能/kJ·mol | 243 | 436 | 431 | 946 |
(1)按要求完成填空
a.2HCl(g) = H2(g)+Cl2(g);△H=
b.N2 (g)+3H2(g)= 2NH3(g) ΔH=-92kJ/mol,则N—H键的键能是
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=CO(g)+ 2H2O(l)ΔH =
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H=-1644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H=-815.88kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式
您最近一年使用:0次



