名校
解题方法
1 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为_______ 。
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。_________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______ 。(填“变大”“变小”或“不变”)
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=__________ 。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=
您最近一年使用:0次
名校
2 . 工业上合成氨工艺流程一般分三步:第一步为原料气的制备,将天然气等原料制成含氢和氮的粗原料气;第二步为净化,主要包括变换过程、脱硫脱碳过程以及气体精制过程;第三步为氨合成,将纯净的氢氮混合气压缩,增大压强,在催化剂的作用下合成氨。
(1)“一次转化”过程中 气体与水蒸气反应转化为
气体与水蒸气反应转化为 和
和 混合气体,已知几种物质的燃烧热如表所示:
混合气体,已知几种物质的燃烧热如表所示:
H2O(l)的汽化热为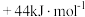 ,则“一次转化”过程中生成
,则“一次转化”过程中生成 的热化学方程式为
的热化学方程式为___________ 。
(2)“二步净化”过程中,原料 、
、 需要经过铜氨液处理净化,除去其中的
需要经过铜氨液处理净化,除去其中的 ,其反应为:
,其反应为: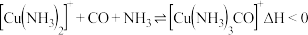 ,铜氨液吸收
,铜氨液吸收 适宜生产条件是
适宜生产条件是___________ (填字母)。
a.低温高压 b.高温高压 c.高温低压 d.低温低压
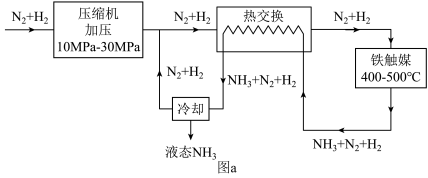
(3)第三步为氨合成,生产流程示意图如图a.已知: 。上述流程中有利于提高原料利用率的措施有
。上述流程中有利于提高原料利用率的措施有___________ 、___________ (请写出两点)。
(4)实验室研究是工业生产的基石。如图b中的实验数据是在其它条件不变时,向 密闭容器中充入
密闭容器中充入 和
和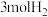 ,不同温度
,不同温度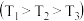 、不同压强下,达平衡时混合物中
、不同压强下,达平衡时混合物中 的物质的量分数的变化情况。
的物质的量分数的变化情况。
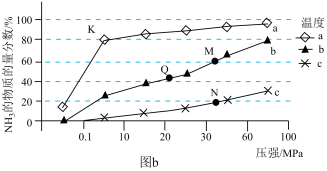
①曲线 对应的温度是
对应的温度是___________ ;
② 、
、 、
、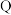 点平衡常数的大小关系是
点平衡常数的大小关系是___________ ; 点的平衡常数为
点的平衡常数为___________ ;
③ 点达平衡后再向容器中充入
点达平衡后再向容器中充入 和
和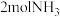 ,平衡将
,平衡将___________ (填“正向移动”、“逆向移动”或“不移动”)。
(1)“一次转化”过程中
 气体与水蒸气反应转化为
气体与水蒸气反应转化为 和
和 混合气体,已知几种物质的燃烧热如表所示:
混合气体,已知几种物质的燃烧热如表所示:| 物质 | 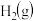 |  | 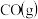 | 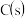 |
燃烧热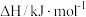 | 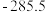 | 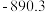 |  | 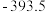 |
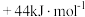 ,则“一次转化”过程中生成
,则“一次转化”过程中生成 的热化学方程式为
的热化学方程式为(2)“二步净化”过程中,原料
 、
、 需要经过铜氨液处理净化,除去其中的
需要经过铜氨液处理净化,除去其中的 ,其反应为:
,其反应为: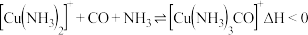 ,铜氨液吸收
,铜氨液吸收 适宜生产条件是
适宜生产条件是a.低温高压 b.高温高压 c.高温低压 d.低温低压
(3)第三步为氨合成,生产流程示意图如图a.已知:
 。上述流程中有利于提高原料利用率的措施有
。上述流程中有利于提高原料利用率的措施有
(4)实验室研究是工业生产的基石。如图b中的实验数据是在其它条件不变时,向
 密闭容器中充入
密闭容器中充入 和
和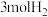 ,不同温度
,不同温度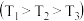 、不同压强下,达平衡时混合物中
、不同压强下,达平衡时混合物中 的物质的量分数的变化情况。
的物质的量分数的变化情况。
①曲线
 对应的温度是
对应的温度是②
 、
、 、
、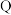 点平衡常数的大小关系是
点平衡常数的大小关系是 点的平衡常数为
点的平衡常数为③
 点达平衡后再向容器中充入
点达平衡后再向容器中充入 和
和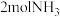 ,平衡将
,平衡将
您最近一年使用:0次
3 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
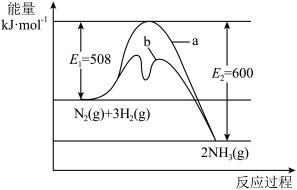
(1)根据图提供的信息,写出该反应的热化学方程式________ ,在图中曲线____ (填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是_______ 。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是____。
(3)一定温度下,向2L密闭容器中充入 和
和 ,保持体积不变,0.5min后达到平衡,测得容器中有
,保持体积不变,0.5min后达到平衡,测得容器中有 ,则平均反应速率
,则平均反应速率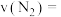
______ , 的转化率为
的转化率为_____ ,该温度下的平衡常数
_____ (此空保留3位小数)。
(4)保持温度和体积不变,向上述平衡体系中再加入 、
、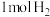 、
、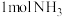 后该反应的速率大小关系为
后该反应的速率大小关系为
____  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(5)反应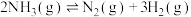
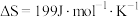 ,在下列温度下反应能自发进行的是______。
,在下列温度下反应能自发进行的是______。

(1)根据图提供的信息,写出该反应的热化学方程式
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是____。
A.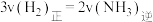 |
B.单位时间内生成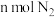 的同时生成 的同时生成 |
| C.混合气体的密度不再改变 |
| D.容器内压强不随时间的变化而变化 |
(3)一定温度下,向2L密闭容器中充入
 和
和 ,保持体积不变,0.5min后达到平衡,测得容器中有
,保持体积不变,0.5min后达到平衡,测得容器中有 ,则平均反应速率
,则平均反应速率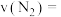
 的转化率为
的转化率为
(4)保持温度和体积不变,向上述平衡体系中再加入
 、
、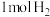 、
、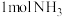 后该反应的速率大小关系为
后该反应的速率大小关系为
 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(5)反应
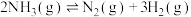
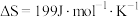 ,在下列温度下反应能自发进行的是______。
,在下列温度下反应能自发进行的是______。| A.25℃ | B.125℃ | C.225℃ | D.325℃ |
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6kJ·mol-1;该反应属于___________ (填“热吸”或“放热”)反应。
(2)常温常压下,1mol乙醇(C2H5OH)完全燃烧生成CO2气体和液态水放出的热量为1367kJ,写出表示乙醇燃烧热的热化学方程式:___________ 。
(3)根据盖斯定律计算:
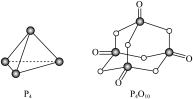
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1 ①
P(红磷,s)+ O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ·mol-1 ②
P4O10(s) ΔH=-738.5kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为___________ 。
(4)已知破坏1mol H−H键、1mol I−I键、1 mol H−I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2 mol HI需要放出___________ kJ的热量。
(5)白磷与氧可发生如下反应:P4+5O2=P4O10,已知断裂下列化学键需要吸收的能量分别为:P−P键 a kJ·mol-1、P−O键bkJ·mol-1、P=O键ckJ·mol-1、O=O键dkJ·mol-1。根据图示的分子结构和有关数据计算该反应的反应热为___________ 。
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6kJ·mol-1;该反应属于
(2)常温常压下,1mol乙醇(C2H5OH)完全燃烧生成CO2气体和液态水放出的热量为1367kJ,写出表示乙醇燃烧热的热化学方程式:
(3)根据盖斯定律计算:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1 ①
P(红磷,s)+
 O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ·mol-1 ②
P4O10(s) ΔH=-738.5kJ·mol-1 ②则白磷转化为红磷的热化学方程式为
(4)已知破坏1mol H−H键、1mol I−I键、1 mol H−I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2 mol HI需要放出
(5)白磷与氧可发生如下反应:P4+5O2=P4O10,已知断裂下列化学键需要吸收的能量分别为:P−P键 a kJ·mol-1、P−O键bkJ·mol-1、P=O键ckJ·mol-1、O=O键dkJ·mol-1。根据图示的分子结构和有关数据计算该反应的反应热为

您最近一年使用:0次
2023-11-07更新
|
320次组卷
|
2卷引用:宁夏吴忠中学2023-2024学年高二上学期11月期中考试化学试题
名校
5 . 乙烯可用作合成纤维、合成橡胶、塑料的原料。回答下列问题:
(1)用CrO3做催化剂,CO2重整C2H6制乙烯的反应过程如下:
C2H6(g) C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
3H2(g)+2CrO3(s)=3H2O(g)+Cr2O3(s) ΔH2;
Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3。
反应C2H6(g)+CO2(g) C2H4(g)+CO(g)+H2O(g)的ΔH=
C2H4(g)+CO(g)+H2O(g)的ΔH=_____ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=_____ ,该反应_____ (填“放热”或“吸热”),能正确表示该反应的图示是_____ (填标号)。
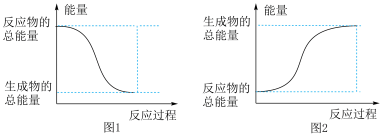
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的燃烧热热化学方程式为_____ 。
(1)用CrO3做催化剂,CO2重整C2H6制乙烯的反应过程如下:
C2H6(g)
 C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;3H2(g)+2CrO3(s)=3H2O(g)+Cr2O3(s) ΔH2;
Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3。
反应C2H6(g)+CO2(g)
 C2H4(g)+CO(g)+H2O(g)的ΔH=
C2H4(g)+CO(g)+H2O(g)的ΔH=(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C O O | H—H | C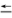 O(CO) O(CO) |
| 键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |

(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的燃烧热热化学方程式为
您最近一年使用:0次
名校
6 . 回答下列问题。
(1)足量 在
在 中完全燃烧生成
中完全燃烧生成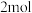 液态水,放出
液态水,放出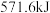 的热量,
的热量, 的燃烧热ΔH=
的燃烧热ΔH=___________ 。
(2)N2H4可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和H2O。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.2kJ·mol-1
写出液体燃料N2H4与液态N2O4反应的热化学方程式:___________ 。
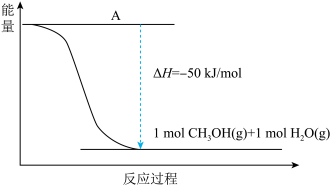
(3)在230℃和催化剂存在的条件下,将CO2与H2转化为CH3OH(g)和H2O(g)。如图为生产1 mol CH3OH(g)的能量变化示意图:

下表为破坏1 mol不同共价键所需的能量(kJ)。试计算:
CO2与H2转化为1 mol CH3OH(g)和H2O(g)的反应为___________ 反应(填吸热或放热),其ΔH=___________ 。
(4)已知下列两个热化学方程式:
 ,
,
 则
则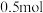 丙烷燃烧生成
丙烷燃烧生成 和气态水时释放的热量为
和气态水时释放的热量为___________ 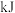
(5)已知:2H2(g)+O2(g)=2H2O(l) ∆H=-571.6kJ/mol,CO(g)+1/2O2(g)=CO2(g) ∆H=-283.0kJ/mol。某 和
和 的混合气体完全燃烧时放出
的混合气体完全燃烧时放出 热量,同时生成
热量,同时生成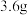 液态水,则原混合气体中
液态水,则原混合气体中 和
和 的物质的量之比为
的物质的量之比为___________ 。
(1)足量
 在
在 中完全燃烧生成
中完全燃烧生成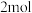 液态水,放出
液态水,放出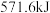 的热量,
的热量, 的燃烧热ΔH=
的燃烧热ΔH=(2)N2H4可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和H2O。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.2kJ·mol-1
写出液体燃料N2H4与液态N2O4反应的热化学方程式:
(3)在230℃和催化剂存在的条件下,将CO2与H2转化为CH3OH(g)和H2O(g)。如图为生产1 mol CH3OH(g)的能量变化示意图:

下表为破坏1 mol不同共价键所需的能量(kJ)。试计算:
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
(4)已知下列两个热化学方程式:

 ,
,
 则
则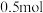 丙烷燃烧生成
丙烷燃烧生成 和气态水时释放的热量为
和气态水时释放的热量为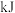
(5)已知:2H2(g)+O2(g)=2H2O(l) ∆H=-571.6kJ/mol,CO(g)+1/2O2(g)=CO2(g) ∆H=-283.0kJ/mol。某
 和
和 的混合气体完全燃烧时放出
的混合气体完全燃烧时放出 热量,同时生成
热量,同时生成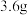 液态水,则原混合气体中
液态水,则原混合气体中 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
7 . I.按要求完成下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______ △H2(填“>”“<”或“=”)。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
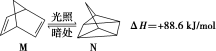
则M、N相比,较稳定的是_______ 。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为_______ 。
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(5)倒入NaOH溶液的正确操作是_______ (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=_______ (取小数点后一位)。
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1
(2)有机物M经过太阳光光照可转化成N,转化过程如下:

则M、N相比,较稳定的是
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是
(5)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
| 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=
您最近一年使用:0次
名校
解题方法
8 . 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是____ 。
①浓H2SO4稀释
②酸碱中和反应
③H2在Cl2中燃烧
④固体NaOH溶于水
⑤液态水变成水蒸气
⑥碳高温条件下还原CO2
(2)沼气是一种能源,它的主要成分是CH4,常温下,0.5molCH4完全燃烧生成CO2(g)和液态水时,放出445kJ热量,则热化学方程式为_____ 。
(3)已知H2S完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为akJ•mol-1,写出H2S的燃烧热的热化学方程式____ 。
(4)已知: N2(g)+
N2(g)+ H2(g)=N(g)+3H(g) ΔH1=+akJ•mol-1
H2(g)=N(g)+3H(g) ΔH1=+akJ•mol-1
N(g)+3H(g)=NH3(g) ΔH2=-bkJ•mol-1
NH3(g)=NH3(l) ΔH3=-ckJ•mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式_____ 。
(5)已知:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ•mol-1
试写出HF电离的热化学方程式_____ 。
(6)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ•mol-1,S-F键能为330kJ•mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式_____ 。
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释
②酸碱中和反应
③H2在Cl2中燃烧
④固体NaOH溶于水
⑤液态水变成水蒸气
⑥碳高温条件下还原CO2
(2)沼气是一种能源,它的主要成分是CH4,常温下,0.5molCH4完全燃烧生成CO2(g)和液态水时,放出445kJ热量,则热化学方程式为
(3)已知H2S完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为akJ•mol-1,写出H2S的燃烧热的热化学方程式
(4)已知:
 N2(g)+
N2(g)+ H2(g)=N(g)+3H(g) ΔH1=+akJ•mol-1
H2(g)=N(g)+3H(g) ΔH1=+akJ•mol-1N(g)+3H(g)=NH3(g) ΔH2=-bkJ•mol-1
NH3(g)=NH3(l) ΔH3=-ckJ•mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式
(5)已知:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ•mol-1
试写出HF电离的热化学方程式
(6)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ•mol-1,S-F键能为330kJ•mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
您最近一年使用:0次
9 . 已知 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
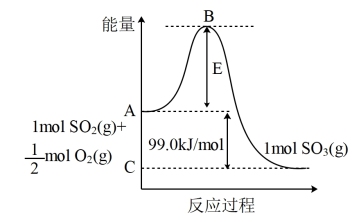
(1)由图可知 为
为___________ (填“吸热”或“放热”)反应。
(2)图中C点表示___________ 。E所代表的能量是___________ ;E的大小对该反应的反应热___________ (填“有”或“无”)影响。
(3)请求出反应
___________ 。
(4)又知 ,请根据题给条件求出反应
,请根据题给条件求出反应 的焓变
的焓变
___________ 。
 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
(1)由图可知
 为
为(2)图中C点表示
(3)请求出反应

(4)又知
 ,请根据题给条件求出反应
,请根据题给条件求出反应 的焓变
的焓变
您最近一年使用:0次
2022-04-04更新
|
320次组卷
|
6卷引用:宁夏银川市贺兰县第一中学2023-2024学年高二上学期第一阶段考试化学试题
名校
解题方法
10 . 回答下列问题:
(1)丙烷(C3H8)热值较高,污染较小,是一种优良的气态燃料。如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,写出表示丙烷燃烧热的热化学方程式:___ 。

(2)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-572kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2598kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H=__ 。
(3)已知25℃、101kpa时,一些物质的燃烧热为:
完成CO和H2生成CH3OH的热化学方程式__ 。
(4)已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为__ kJ•mol-1。
(1)丙烷(C3H8)热值较高,污染较小,是一种优良的气态燃料。如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,写出表示丙烷燃烧热的热化学方程式:

(2)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-572kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2598kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H=
(3)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 |
完成CO和H2生成CH3OH的热化学方程式
(4)已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为
您最近一年使用:0次
2021-12-04更新
|
266次组卷
|
2卷引用:宁夏银川一中2021-2022学年高二上学期期中考试化学试题



