名校
1 . 金(Au)广泛应用于电子信息产业,一种从被FeS2包裹的含金矿物中提金的工艺流程如下:

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式_______ 。
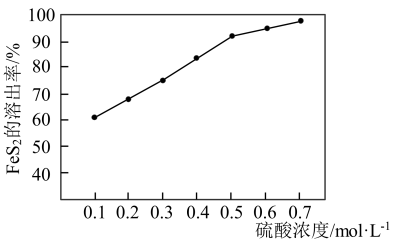
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是_______ 。
(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为_______ 。
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

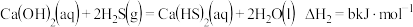

_______ 。
(3)“置换”时需维持无氧环境,其主要原因是_______ 。
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知: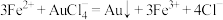

计算样品中金的质量分数(写出计算过程)_______ 。

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体∙OH,∙OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是

(2)①“浸取”时Au转化为配合物NH4[Au(SCN)4],该配合物中的配体为
②“浸取”时可使用硫脲[SC(NH2)2]代替NH4SCN,硫脲可通过下列反应制备:

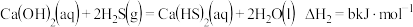

(3)“置换”时需维持无氧环境,其主要原因是
(4)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000 mol·L-1FeSO4溶液30.00mL,将HAuCl4完全还原为Au;滴加二苯胺磺酸钠作指示剂,用0.1000 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知:
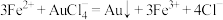

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
2022-10-24更新
|
292次组卷
|
2卷引用:江苏省宿迁市泗阳县实验高级中学2022-2023学年高三上学期第一次质量调研化学试题
名校
2 . 为探究合成气制甲醇过程中催化剂中毒的原因,将模拟合成气( 、
、 和
和 按一定比例混合)以一定流速分别通过三份铜基催化剂,其中一份做空白实验,两份强制中毒(分别预先吸附
按一定比例混合)以一定流速分别通过三份铜基催化剂,其中一份做空白实验,两份强制中毒(分别预先吸附 和
和 ,吸附反应后催化剂中碱元素的质量分数相等)。在一定温度下,总碳(
,吸附反应后催化剂中碱元素的质量分数相等)。在一定温度下,总碳( 、
、 )转化率、生成
)转化率、生成 的选择性与反应时间的关系如题图所示。
的选择性与反应时间的关系如题图所示。

生成 的选择性
的选择性 。合成气制甲醇的主要反应为:
。合成气制甲醇的主要反应为:
反应Ⅰ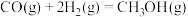
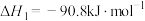
反应Ⅱ
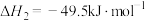
副反应有: ,
, ,
, 。
。
下列说法正确的是
 、
、 和
和 按一定比例混合)以一定流速分别通过三份铜基催化剂,其中一份做空白实验,两份强制中毒(分别预先吸附
按一定比例混合)以一定流速分别通过三份铜基催化剂,其中一份做空白实验,两份强制中毒(分别预先吸附 和
和 ,吸附反应后催化剂中碱元素的质量分数相等)。在一定温度下,总碳(
,吸附反应后催化剂中碱元素的质量分数相等)。在一定温度下,总碳( 、
、 )转化率、生成
)转化率、生成 的选择性与反应时间的关系如题图所示。
的选择性与反应时间的关系如题图所示。
生成
 的选择性
的选择性 。合成气制甲醇的主要反应为:
。合成气制甲醇的主要反应为:反应Ⅰ
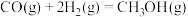
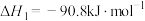
反应Ⅱ

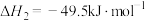
副反应有:
 ,
, ,
, 。
。下列说法正确的是
A.实验条件下,三个副反应的 均小于0 均小于0 |
| B.空白实验时,若其他条件不变,升高温度,总碳转化率一定减小 |
C.相同条件下, 对催化剂的毒害作用大于 对催化剂的毒害作用大于 |
D.为提高生成 的选择性,可研发不与含硫物反应的催化剂 的选择性,可研发不与含硫物反应的催化剂 |
您最近一年使用:0次
2022-05-24更新
|
932次组卷
|
6卷引用:江苏省扬州市2022届高三考前调研测试化学试题
江苏省扬州市2022届高三考前调研测试化学试题江苏省扬州中学2022届高三下学期考前模拟(三)化学试题(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)江苏省盐城中学2023届高三第二次模拟考试(4月)化学试题(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
3 . 用 分子筛催化1-丁烯裂解制丙烯的反应体系中,主要发生的反应如下:
分子筛催化1-丁烯裂解制丙烯的反应体系中,主要发生的反应如下:
反应Ⅰ:
反应Ⅱ:
已知催化剂 分子筛的筛孔径越小,越有利于生成碳原子数少的产物。在0.5MPa下,上述体系平衡时丁烯、丙烯、乙烯的质量分数与温度的关系如图所示。下列说法正确的是
分子筛的筛孔径越小,越有利于生成碳原子数少的产物。在0.5MPa下,上述体系平衡时丁烯、丙烯、乙烯的质量分数与温度的关系如图所示。下列说法正确的是

 分子筛催化1-丁烯裂解制丙烯的反应体系中,主要发生的反应如下:
分子筛催化1-丁烯裂解制丙烯的反应体系中,主要发生的反应如下:反应Ⅰ:

反应Ⅱ:

已知催化剂
 分子筛的筛孔径越小,越有利于生成碳原子数少的产物。在0.5MPa下,上述体系平衡时丁烯、丙烯、乙烯的质量分数与温度的关系如图所示。下列说法正确的是
分子筛的筛孔径越小,越有利于生成碳原子数少的产物。在0.5MPa下,上述体系平衡时丁烯、丙烯、乙烯的质量分数与温度的关系如图所示。下列说法正确的是
| A.图中曲线X表示丁烯的质量分数随温度的变化 |
| B.在0.5MPa下,该工艺选择的适宜温度为300℃ |
C. 的 的 |
D.高于500℃,丙烯质量分数降低可能是因为裂解产生的碳颗粒附着在 分子筛的筛孔上所致 分子筛的筛孔上所致 |
您最近一年使用:0次
2022-01-24更新
|
378次组卷
|
5卷引用:江苏省泰州市2021-2022学年高三上学期期末考试化学试题
江苏省泰州市2021-2022学年高三上学期期末考试化学试题江苏省无锡市太湖高级中学2021-2022学年高二下学期3月月考化学试题南京市第一中学2021-2022学年高二下学期3月阶段检测化学试题江苏省句容高级中学2022-2023学年高二上学期期末调研化学试题(已下线)专题08 化学反应速率与化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)
解题方法
4 . 含N元素的部分物质对环境有影响。含NO、 的废气会引起空气污染,含
的废气会引起空气污染,含 、
、 、
、 的废水会引起水体富营养化,都需要经过处理后才能排放。
的废水会引起水体富营养化,都需要经过处理后才能排放。
(1)氢气催化还原含NO烟气:
主反应: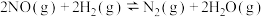
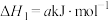
副反应: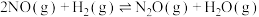

①已知NO也能与 反应生成
反应生成 ,写出该反应的热化学方程式
,写出该反应的热化学方程式___________ 。
②某温度下 的体积分数对
的体积分数对 还原NO反应的影响如图1所示。当
还原NO反应的影响如图1所示。当 的体积分数大于
的体积分数大于 时,
时, 的体积分数呈下降趋势,原因是
的体积分数呈下降趋势,原因是___________ 。
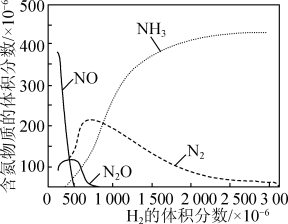
图1
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图2所示,写出电解时铁电极的电极反应式___________ 。随后,铁电极附近有无色气体产生,写出有关反应的离子方程式___________ 。
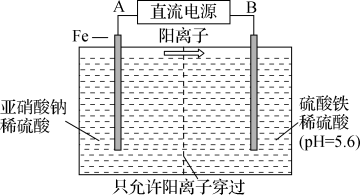
图2
(3)工业上以钛基氧化物涂层材料为阳极,碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使 转变为
转变为 ,后续再将
,后续再将 反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。
反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。
①若在酸性介质中电解混合溶液,将 转变为
转变为 的电极反应式为
的电极反应式为___________ ;其他条件不变,只改变混合溶液的pH, 去除率如图3所示,pH越小,
去除率如图3所示,pH越小, 去除率上升可能原因是
去除率上升可能原因是___________ 。
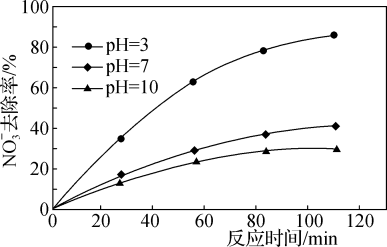
图3
②其他条件不变,只向混合溶液中投入一定量 ,后续去除
,后续去除 的效果明显提高,溶液中氮元素含量显著降低。可能原因是
的效果明显提高,溶液中氮元素含量显著降低。可能原因是___________ 。
 的废气会引起空气污染,含
的废气会引起空气污染,含 、
、 、
、 的废水会引起水体富营养化,都需要经过处理后才能排放。
的废水会引起水体富营养化,都需要经过处理后才能排放。(1)氢气催化还原含NO烟气:
主反应:
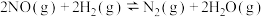
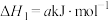
副反应:
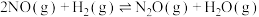

①已知NO也能与
 反应生成
反应生成 ,写出该反应的热化学方程式
,写出该反应的热化学方程式②某温度下
 的体积分数对
的体积分数对 还原NO反应的影响如图1所示。当
还原NO反应的影响如图1所示。当 的体积分数大于
的体积分数大于 时,
时, 的体积分数呈下降趋势,原因是
的体积分数呈下降趋势,原因是
图1
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图2所示,写出电解时铁电极的电极反应式

图2
(3)工业上以钛基氧化物涂层材料为阳极,碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使
 转变为
转变为 ,后续再将
,后续再将 反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。
反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。①若在酸性介质中电解混合溶液,将
 转变为
转变为 的电极反应式为
的电极反应式为 去除率如图3所示,pH越小,
去除率如图3所示,pH越小, 去除率上升可能原因是
去除率上升可能原因是
图3
②其他条件不变,只向混合溶液中投入一定量
 ,后续去除
,后续去除 的效果明显提高,溶液中氮元素含量显著降低。可能原因是
的效果明显提高,溶液中氮元素含量显著降低。可能原因是
您最近一年使用:0次
2023-07-23更新
|
159次组卷
|
2卷引用:江苏省扬州市高邮市2022-2023学年高二上学期10月月考化学试题
5 . 我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发CO2资源化利用技术,降低空气中CO2含量成为世界各国研究热点。
(1)CO2和CH4重整可制合成气(主要成分为CO和H2),其热化学反应方程式:
CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247kJ·mol-1
已知下列热化学反应方程式:
反应1:C(s)+2H2(g) = CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2 =-40.0kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3 =+132.0kJ·mol-1
①ΔH1 =_______ kJ·mol-1
②CO(g)+H2O(l)=CO2(g)+H2(g) ΔH_______ -40.0kJ·mol-1(填“<”“>”或“=”)
③反应3中加入催化剂,ΔH3_______ (填“减小”“增大”或“不变”)
(2)二甲醚(CH3OCH3)被认为是最具潜力的燃料。在密闭容器中充入CO2与H2反应可以制得CH3OCH3:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):

①该反应为_______ 反应(填“吸热”或“放热”)
②下列哪种情况的活化能更大_______
a. 催化剂A作用下的反应 b. 催化剂B作用下的反应
③600K达到平衡时,反应在催化剂A作用下的转化率_______ (填“高于”、“低于”或“等于”)在催化剂B作用下的转化率。
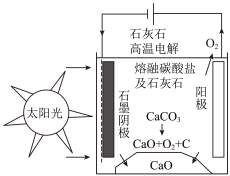
(3)研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO - 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为
- 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为_______ 。
(1)CO2和CH4重整可制合成气(主要成分为CO和H2),其热化学反应方程式:
CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247kJ·mol-1
已知下列热化学反应方程式:
反应1:C(s)+2H2(g) = CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2 =-40.0kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3 =+132.0kJ·mol-1
①ΔH1 =
②CO(g)+H2O(l)=CO2(g)+H2(g) ΔH
③反应3中加入催化剂,ΔH3
(2)二甲醚(CH3OCH3)被认为是最具潜力的燃料。在密闭容器中充入CO2与H2反应可以制得CH3OCH3:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):
①该反应为
②下列哪种情况的活化能更大
a. 催化剂A作用下的反应 b. 催化剂B作用下的反应
③600K达到平衡时,反应在催化剂A作用下的转化率
(3)研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO
 - 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为
- 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为
您最近一年使用:0次
6 . 页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供于开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=_______ kJ/mol。
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。
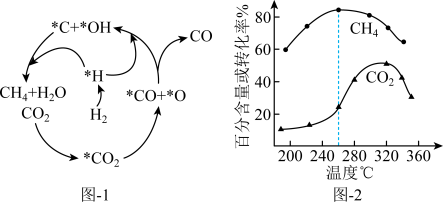
①260℃时,生成生要产物的所发生反应的化学方程式为_______ 。
②温度高于320℃,CO2的转化率下降的原因是_______ 。
③描述CO2转化为CO的反应机理_______ 。
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。
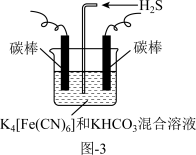
(3)电解时,阳极的电极反应式为_______ 。
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。
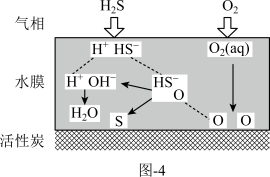
其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是_______ 。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。

①260℃时,生成生要产物的所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
③描述CO2转化为CO的反应机理
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。

(3)电解时,阳极的电极反应式为
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。

其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
您最近一年使用:0次
解题方法
7 . “温室效应”是全球关注的环境问题之一。 是目前大气中含量最高的一种温室气体,
是目前大气中含量最高的一种温室气体, 的综合利用是解决温室及能源问题的有效途径。
的综合利用是解决温室及能源问题的有效途径。
(1)研究表明 和
和 在催化存在下可发生反应生成
在催化存在下可发生反应生成 。已知部分反应的热化学方程式如下:
。已知部分反应的热化学方程式如下:

 ;
;
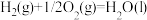
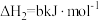 ;
;
则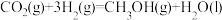

_______ 。
(2) 催化加氢也能合成低碳烯烃:
催化加氢也能合成低碳烯烃: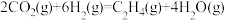 ,不同温度下平衡时的四种气态物质的物质的量如图所示,曲线c表示的物质为
,不同温度下平衡时的四种气态物质的物质的量如图所示,曲线c表示的物质为_______ (填化学式)。

(3) 和
和 在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成
在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成 和CO。
和CO。
反应A: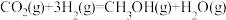
反应B: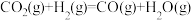
控制 和
和 初始投料比为1∶3时,温度对
初始投料比为1∶3时,温度对 平衡转化率及甲醇和CO产率的影响如图所示。
平衡转化率及甲醇和CO产率的影响如图所示。
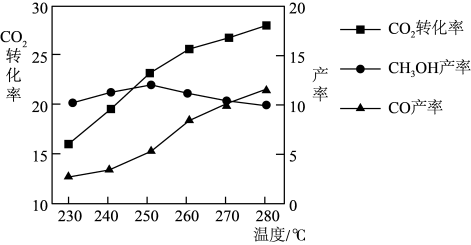
①由图可知获取 最适宜的温度是
最适宜的温度是_______ 。
②下列措施不能提高 转化为
转化为 的平衡转化率的有
的平衡转化率的有_______ (填字母)。
A.使用催化剂 B.增大体系压强 C.增大 和
和 初始投料比
初始投料比
(4)在催化剂表面通过施加电压可将溶解在酸性溶液中的二氧化碳直接转化为乙醇,则生成乙醇的电极反应式为_______ 。
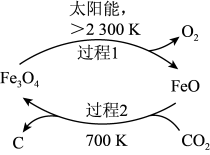
(5)由 制取C的太阳能工艺如图所示。请用文字描述该过程
制取C的太阳能工艺如图所示。请用文字描述该过程_______ 。
 是目前大气中含量最高的一种温室气体,
是目前大气中含量最高的一种温室气体, 的综合利用是解决温室及能源问题的有效途径。
的综合利用是解决温室及能源问题的有效途径。(1)研究表明
 和
和 在催化存在下可发生反应生成
在催化存在下可发生反应生成 。已知部分反应的热化学方程式如下:
。已知部分反应的热化学方程式如下:
 ;
;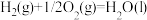
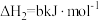 ;
;则
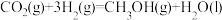

(2)
 催化加氢也能合成低碳烯烃:
催化加氢也能合成低碳烯烃: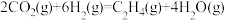 ,不同温度下平衡时的四种气态物质的物质的量如图所示,曲线c表示的物质为
,不同温度下平衡时的四种气态物质的物质的量如图所示,曲线c表示的物质为
(3)
 和
和 在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成
在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成 和CO。
和CO。反应A:
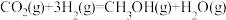
反应B:
控制
 和
和 初始投料比为1∶3时,温度对
初始投料比为1∶3时,温度对 平衡转化率及甲醇和CO产率的影响如图所示。
平衡转化率及甲醇和CO产率的影响如图所示。
①由图可知获取
 最适宜的温度是
最适宜的温度是②下列措施不能提高
 转化为
转化为 的平衡转化率的有
的平衡转化率的有A.使用催化剂 B.增大体系压强 C.增大
 和
和 初始投料比
初始投料比(4)在催化剂表面通过施加电压可将溶解在酸性溶液中的二氧化碳直接转化为乙醇,则生成乙醇的电极反应式为
(5)由
 制取C的太阳能工艺如图所示。请用文字描述该过程
制取C的太阳能工艺如图所示。请用文字描述该过程
您最近一年使用:0次
8 . 页岩气的主要成分为CH4,还含有少量的CO2、H2S等气体,工业上可采用下列方法除去其中的CO2、H2S。
I.CO2的处理:
(1)CO2和CH4重整可制得合成气(CO、H2)。已知下列热化学反应方程式:
CH4(g)=C(s)+2H2(g); ΔH=74.5kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g); ΔH=40.0kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g); ΔH=+132.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=___________ kJ·mol-1。
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。
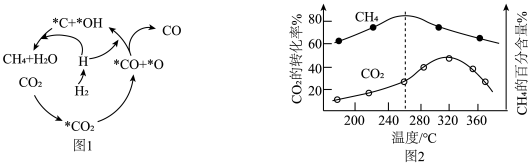
①260℃时生成主要产物所发生反应的化学方程式为___________ 。
②温度高于320℃,CO2的转化率下降的原因是___________ 。
(3)利用电解转化法从烟气中分离CO2的原理如图3所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:___________ 。

II.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂,其脱硫和再生的原理如图4所示。
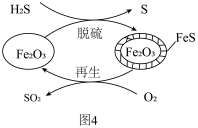
(4)Fe2O3脱硫剂的脱硫和再生过程可以描述为___________ 。
(5)脱硫剂再生时可以使用水蒸气代替O2,700℃条件下生成Fe3O4、H2S和H2.采用O2和水蒸气混合再生的方法,可以将产生的SO2和H2S全部转化为S单质。理论上O2和水蒸气的物质的量之比应为___________ 。
I.CO2的处理:
(1)CO2和CH4重整可制得合成气(CO、H2)。已知下列热化学反应方程式:
CH4(g)=C(s)+2H2(g); ΔH=74.5kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g); ΔH=40.0kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g); ΔH=+132.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。

①260℃时生成主要产物所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
(3)利用电解转化法从烟气中分离CO2的原理如图3所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:

II.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂,其脱硫和再生的原理如图4所示。

(4)Fe2O3脱硫剂的脱硫和再生过程可以描述为
(5)脱硫剂再生时可以使用水蒸气代替O2,700℃条件下生成Fe3O4、H2S和H2.采用O2和水蒸气混合再生的方法,可以将产生的SO2和H2S全部转化为S单质。理论上O2和水蒸气的物质的量之比应为
您最近一年使用:0次
名校
解题方法
9 . 甲醛有毒,被世界卫生组织列为一类致癌物。但甲醛是重要的工业原料,在化工、纺织、医疗等领域有广泛应用。
Ⅰ.回收利用 是一种减弱温室效应的有效途径。科学家研究发现可利用回收的
是一种减弱温室效应的有效途径。科学家研究发现可利用回收的 与
与 反应制备甲醛。
反应制备甲醛。
已知:①甲醛的燃烧热为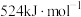
② 的燃烧热为
的燃烧热为
③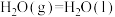
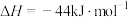
(1) 与
与 制备甲醛的反应:
制备甲醛的反应:

_______ 。
(2)在2L恒容密闭容器中通入0.2mol 和0.4mol
和0.4mol ,在三种不同条件下发生(1)中反应,测得
,在三种不同条件下发生(1)中反应,测得 的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=
的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=_______ ,由曲线Y到曲线X采取的措施可能是_______ ;由曲线Z到曲线X采取的措施可能是_______ 。
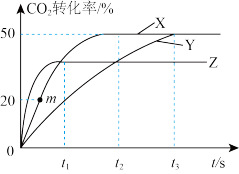
(3)反应速率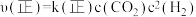 ,
,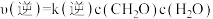 ,
, 、
、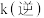 分别为正、逆向反应速率常数,计算m点
分别为正、逆向反应速率常数,计算m点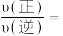
_______ 。
Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。
(4)在一个2L恒容密闭容器中投入2mol ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: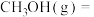
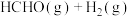
 ,同时存在副反应:
,同时存在副反应: 。
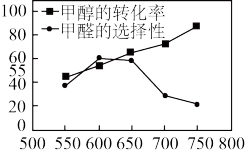
。 。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率
。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率_______ ,原因可能是_______ 。
(5)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示,则a电极反应式为_______ 。国家标准是室内甲醛不能超过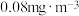 ,传感器在
,传感器在 室内空间测定,电路中有
室内空间测定,电路中有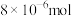 电子通过,该室内甲醛含量为
电子通过,该室内甲醛含量为_______ 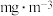 。
。

Ⅰ.回收利用
 是一种减弱温室效应的有效途径。科学家研究发现可利用回收的
是一种减弱温室效应的有效途径。科学家研究发现可利用回收的 与
与 反应制备甲醛。
反应制备甲醛。已知:①甲醛的燃烧热为
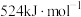
②
 的燃烧热为
的燃烧热为
③
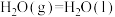
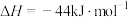
(1)
 与
与 制备甲醛的反应:
制备甲醛的反应:

(2)在2L恒容密闭容器中通入0.2mol
 和0.4mol
和0.4mol ,在三种不同条件下发生(1)中反应,测得
,在三种不同条件下发生(1)中反应,测得 的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=
的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=
(3)反应速率
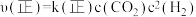 ,
,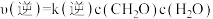 ,
, 、
、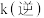 分别为正、逆向反应速率常数,计算m点
分别为正、逆向反应速率常数,计算m点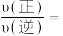
Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。
(4)在一个2L恒容密闭容器中投入2mol
 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: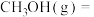
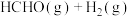
 ,同时存在副反应:
,同时存在副反应: 。
。 。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率
。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率
(5)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示,则a电极反应式为
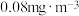 ,传感器在
,传感器在 室内空间测定,电路中有
室内空间测定,电路中有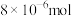 电子通过,该室内甲醛含量为
电子通过,该室内甲醛含量为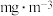 。
。
您最近一年使用:0次
2022-09-06更新
|
329次组卷
|
3卷引用:江苏省响水中学2022-2023学年高二(创新班)上学期10月学情分析考试化学试题
江苏省响水中学2022-2023学年高二(创新班)上学期10月学情分析考试化学试题河北省邢台市名校联盟2022-2023学年高三上学期开学考试化学试题(已下线)2022年河北省高考真题变式题(14-18)
名校
10 . SO2、NOx是空气的主要污染物,有效去除大气中的SO2、NOx可以保护大气环境。含氮废水氨氮(以NH3、NH 存在)和硝态氮(以NO
存在)和硝态氮(以NO 、NO
、NO 存在)引起水体富营养化,需经处理后才能排放。
存在)引起水体富营养化,需经处理后才能排放。
(1)用天然碱生产小苏打的母液(主要溶质为碳酸钠)吸收烟气中SO2的相关反应的热化学方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)=Na2SO3(aq)+2NaHCO3(aq) ΔH=akJ•mol-1
2NaHCO3(aq)+SO2(g)=Na2SO3(aq)+2CO2(g)+H2O(l) ΔH=bkJ•mol-1
Na2SO3(aq)+SO2(g)+H2O(l)=2NaHSO3(aq) ΔH=ckJ•mol-1
反应Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g)的ΔH=___ kJ•mol-1。
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图1所示,写出电解时铁电极发生的电极反应式:___ 。随后,铁电极附近有无色气体产生,写出有关反应的离子方程式:___ 。

(3)工业上以钛基氧化物涂层材料为阳极、碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使NO ,变为NH
,变为NH 。电极(电催化剂)所处的环境对其催化活性到重要作用。
。电极(电催化剂)所处的环境对其催化活性到重要作用。
①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH 的效果明显提高,溶液中氮元素含量显著降低。可能原因是
的效果明显提高,溶液中氮元素含量显著降低。可能原因是___ 。
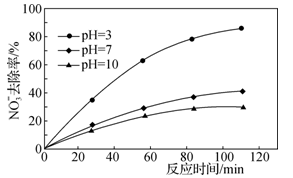
②其他条件不变,只改变溶液的pH,NO 去除率如图2所示,pH升高时,去除率
去除率如图2所示,pH升高时,去除率___ (“升高”或“下降”),可能原因是___ 。
(4)厌氧氨化法(Anammox)是一种新型的氨氮去除技术,反应模型如图所示。
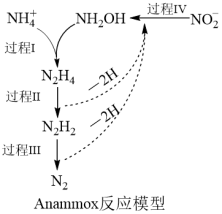
氨氮去除的过程可以描述为:___ 。
 存在)和硝态氮(以NO
存在)和硝态氮(以NO 、NO
、NO 存在)引起水体富营养化,需经处理后才能排放。
存在)引起水体富营养化,需经处理后才能排放。(1)用天然碱生产小苏打的母液(主要溶质为碳酸钠)吸收烟气中SO2的相关反应的热化学方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)=Na2SO3(aq)+2NaHCO3(aq) ΔH=akJ•mol-1
2NaHCO3(aq)+SO2(g)=Na2SO3(aq)+2CO2(g)+H2O(l) ΔH=bkJ•mol-1
Na2SO3(aq)+SO2(g)+H2O(l)=2NaHSO3(aq) ΔH=ckJ•mol-1
反应Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g)的ΔH=
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图1所示,写出电解时铁电极发生的电极反应式:

(3)工业上以钛基氧化物涂层材料为阳极、碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使NO
 ,变为NH
,变为NH 。电极(电催化剂)所处的环境对其催化活性到重要作用。
。电极(电催化剂)所处的环境对其催化活性到重要作用。①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH
 的效果明显提高,溶液中氮元素含量显著降低。可能原因是
的效果明显提高,溶液中氮元素含量显著降低。可能原因是②其他条件不变,只改变溶液的pH,NO
 去除率如图2所示,pH升高时,去除率
去除率如图2所示,pH升高时,去除率
(4)厌氧氨化法(Anammox)是一种新型的氨氮去除技术,反应模型如图所示。

氨氮去除的过程可以描述为:
您最近一年使用:0次
2021-12-23更新
|
686次组卷
|
5卷引用:江苏省姜堰中学、如东中学、前黄中学三校2021- 2022学年高三联考化学试题
江苏省姜堰中学、如东中学、前黄中学三校2021- 2022学年高三联考化学试题江苏省扬州中学2021-2022学年高二下学期开学考试化学试题(已下线)黄金卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省徐州市第七中学2021-2022学年高三下学期2月检测化学试题江苏省前黄高级中学、如东中学、姜堰中学2021-2022学年高三上学期12月份阶段性测试化学试题



