9-10高二下·安徽·期中
名校
解题方法
1 . 已知热化学方程式:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
 O2(g)
O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为| A.196.64kJ | B.196.64kJ/mol | C.<196.64kJ | D.>196.64kJ |
您最近一年使用:0次
2021-02-23更新
|
377次组卷
|
58卷引用:2012-2013学年天津市天津一中高二上学期期中考试化学试卷
(已下线)2012-2013学年天津市天津一中高二上学期期中考试化学试卷天津市杨柳青一中2017-2018第一学期高二第一次化学月考(已下线)2010年安徽师大附中高二第二学期期中考查(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2010-2011学年广东省中山市桂山中学高二下期中考试化学试卷(已下线)2010—2011学年浙江省杭州外国语学校高二年级下学期期中考试化学试卷(已下线)2011-2012学年江西省会昌中学高二第二次月考化学试卷(已下线)2011-2012学年河南省濮阳市高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省开化县华埠中学高二下学期3月月考试卷(已下线)2011-2012学年浙江省余姚中学高一下学期期中考试理科化学试卷(已下线)2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷(已下线)2012-2013学年河南省郑州四中高二第一次月考化学试卷(已下线)2012-2013学年吉林省扶余一中高二上学期期末考试化学试卷(已下线)2013-2014学年内蒙古赤峰市元宝山区高二上学期期末化学试卷(已下线)2014秋河北省唐山一中高二上学期期中化学试卷2014-2015学年内蒙古巴市一中高二10月月考化学试卷2014-2015内蒙古赤峰市宁城县高二上学期期末考试化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2015-2016学年海南省嘉积中学高二上12月段考化学试卷2017届山东省枣庄三中高三上学期9月质检化学试卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷河北省保定市2016-2017学年高一下学期期中考试化学试题陕西省西安市电子科技中学2017-2018学年高二上学期第一次月考化学试题福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题河北省邢台第三中学2017-2018学年高二9月月考化学试题甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题内蒙古翁牛特旗乌丹第二中学2017-2018学年高二上学期期中考试化学试题福建省三明市三地三校2017-2018学年高二上学期期中联考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题甘肃省岷县第二中学2018-2019学年高二上学期期中考试化学试题甘肃省白银市靖远县第四中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第二章 第三节 化学平衡【校级联考】吉林省辽源市田家炳高级中学(第六十六届友好学校)2018-2019学年高二上学期期末联考化学试题江苏省沭阳县2018-2019学年高二下学期期中调研测试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题河北省张家口市宣化一中、张北一中2019-2020学年高二上学期期中联考化学试题河南省鹤壁市高级中学2018-2019学年高一下学期第一次段考化学试题河北省张家口市怀来县新保安第二中学2019-2020学年高二上学期11月月考化学试题2020年春季人教版高中化学选修4第一章《化学反应与能量》测试卷云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题江西省赣州市南康中学2020-2021学年高二上学期第一次月考化学试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题吉林省榆树市第一高级中学2020-2021学年高二上学期期中考试化学试题云南省保山第九中学2019-2020学年高二下学期期末考试化学试题陕西省西安市庆华中学2020-2021学年高二上学期第一次月考化学试题湖南省郴州市湘南中学2019-2020学年高二上学期期中考试化学试题(高考班)天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期期中考试化学试题陕西省西安市鄠邑区第二中学2022-2023学年高二上学期第一次月考化学试题 河南省兰考县第二高级中学2021-2022学年高二上学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题
名校
解题方法
2 . 热化学方程式2H2O2(l) 2H2O(l)+O2(g)
2H2O(l)+O2(g)  kJ·mol
kJ·mol 说法正确的是
说法正确的是
 2H2O(l)+O2(g)
2H2O(l)+O2(g)  kJ·mol
kJ·mol 说法正确的是
说法正确的是| A.生成11.2LO2时放热98kJ | B.反应物总能量小于生成物总能量 |
| C.H2O为气态时,放出的热量大于196kJ | D.正反应的活化能小于逆反应的活化能 |
您最近一年使用:0次
2021-02-08更新
|
1839次组卷
|
12卷引用:江西省永丰县永丰中学2020-2021学年高二上学期期中考试化学试题
江西省永丰县永丰中学2020-2021学年高二上学期期中考试化学试题天津北京师范大学静海附属学校2021-2022学年高二上学期第一次调研测试化学试题(已下线)1.1.2 热化学方程式-2021-2022学年高二化学课后培优练(人教版选修4)课前-1.1.2 热化学方程式 燃烧热-课前、课中、课后(人教版2019选择性必修1)(已下线)1.1.2 热化学方程式 燃烧热(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第02讲 热化学方程式与燃烧热(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)甘肃省兰州第一中学2022-2023学年高二上学期期中考试化学试题福建省莆田第六中学2022-2023学年高二上学期第二次月考(A卷)化学试题福建省莆田第六中学2022-2023学年高二上学期第二次月考(B卷)化学试题江西省南昌市知行中学2022-2023学年高二上学期11月份作业练习(月考)化学试题四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题
解题方法
3 . 反应N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol表示的意义为
2NH3(g) △H=-92.4kJ/mol表示的意义为
 2NH3(g) △H=-92.4kJ/mol表示的意义为
2NH3(g) △H=-92.4kJ/mol表示的意义为| A.1 mol N2 和3 mol H2 充入密闭容器中反应放出92.4kJ热量 |
| B.1 mol N2 和3 mol H2 充入密闭容器中反应吸收92.4kJ热量 |
| C.每生成2 mol NH3 放出92.4 kJ热量 |
| D.每生成2 mol NH3 吸收92.4 kJ热量 |
您最近一年使用:0次
4 . 氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别为:
H2 (g) + O2(g) = H2O (l) △H = -285.8 kJ /mol
O2(g) = H2O (l) △H = -285.8 kJ /mol
CO(g) + O2(g) = CO2(g) △H = -283 kJ /mol
O2(g) = CO2(g) △H = -283 kJ /mol
C8H18 (l) +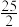 O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
CH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H = -890.3 kJ /mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
H2 (g) +
 O2(g) = H2O (l) △H = -285.8 kJ /mol
O2(g) = H2O (l) △H = -285.8 kJ /molCO(g) +
 O2(g) = CO2(g) △H = -283 kJ /mol
O2(g) = CO2(g) △H = -283 kJ /molC8H18 (l) +
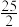 O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /molCH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H = -890.3 kJ /mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
| A.H2 (g) | B.CO(g) | C.C8H18 (l) | D.CH4 (g) |
您最近一年使用:0次
2020-09-30更新
|
526次组卷
|
31卷引用:2015-2016学年天津市和平区高二上学期期末考试化学试卷
2015-2016学年天津市和平区高二上学期期末考试化学试卷(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二上学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二第一学段(模块)考试化学试卷(已下线)2011-2012学年河北省辛集三中高二化学选修四期中试卷(已下线)2012年人教版高中化学选修4 1.1化学反应与能量的变化练习卷(已下线)2012年苏教版高中化学选修4 1.1化学反应中的热效应(已下线)2015届安徽省望江中学同步课时练(人教选修4)1.2 燃烧热能源试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷河北省邢台第三中学2017-2018学年高二9月月考化学试题四川省成都市七中实验学校2017-2018学年高二10月月考化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题22018-2019学年人教版高二化学选修四章:化学反应与能量末测试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)高二人教版选修4 第一章 第三节 化学反应热的计算【校级联考】河北省鸡泽县第一中学2018-2019学年高一下学期3月月考化学试题陕西省吴起高级中学2018-2019学年高一下学期第二次月考基础卷化学试题(已下线)2019年8月29日《每日一题》人教选修4—— 燃烧热的计算山东省德州市夏津县双语中学2019-2020学年高二上学期第二次月考化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题云南省勐海县第三中学2019-2020学年高二上学期期末考试化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)宁夏石嘴山市第三中学2020-2021学年高二上学期第一次月考化学试题湖南省娄底市第一中学2020-2021学年高二上学期9月月考化学试题河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题甘肃省玉门市2021-2022学年高二上学期 “研课标读教材”期中学业质量监测化学试题甘肃省玉门市2021-2022学年高二下学期 “研课标读教材”期中学业质量监测试化学试题(一)(已下线)1.1.2 反应热(二)-同步学习必备知识
5 . 通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
| A.反应①中电能转化为化学能 |
| B.反应②为放热反应 |
| C.反应③使用催化剂,ΔH3减小 |
| D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1 |
您最近一年使用:0次
2020-09-02更新
|
3805次组卷
|
106卷引用:2016年全国普通高等学校招生统一考试化学(江苏卷精编版)
2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2015-2016学年吉林省松原市油田高中高一下期末化学试卷2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届河北省沧州市第一中学高三上周测化学试卷2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷2017届河北省石家庄二中高三上第二期联考化学试卷2016-2017学年山东省枣庄二中高二第二次月考化学试卷2017届河南省开封市高三上学期10月定位考试化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届河南省郑州一中高三上期中化学试卷2017届辽宁省沈阳二中高三上期中化学试卷2016-2017学年江西省樟树中学高二上第二次月考化学试卷2017届宁夏银川一中高三上月考四化学试卷2016-2017学年云南省曲靖一中高二上期中化学试卷2016-2017学年江西省樟树中学高二上月考二化学试卷2016-2017学年山东省济宁市历城区高二上期中化学试卷2016-2017学年辽宁东北育才学校高二上阶段考二化学卷2016-2017学年江苏省扬州中学高二12月月考化学卷2017届宁夏六盘山高级中学高三上月考二化学卷2016-2017学年广东省仲元中学高二上学期期末考试化学(理)试卷江苏省徐州市2016-2017学年高二下学期期中考试化学试题辽宁省鞍山市第一中学2016-2017学年高一下学期期中考试化学试题辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷苏教版2017届高三单元精练检测六化学试题吉林省延边安图第一中学2016-2017学年高二练习化学试题2018版化学(苏教版)高考总复习专题六对接高考精练--化学反应的热效应山东省济南市外国语学校2017-2018学年高二10月月考(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题黑龙江省大庆实验中学2018届高三上学期期中考试理科综合化学试题福建省南安第一中学2017-2018学年高二上学期期中考试化学试题山东省枣庄市薛城区2017-2018学年高二上学期期末化学试题(已下线)《考前20天终极攻略》-5月24日 盖斯定律及反应热的有关计算(已下线)解密08 化学反应与热能(教师版)——备战2018年高考化学之高频考点解密人教版2017届高三单元精练检测六化学试题湖南省醴陵市第一中学2018-2019学年高二上学期入学考试化学试题2018-2019学年人教版高中化学选修四模块综合测评题广东省蓝精灵中学2018-2019学年高二上学期联考化学试题【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题甘肃省兰州第一中学2018-2019学年高二(理)上学期期中考试化学试题【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题福建省惠安惠南中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点2016年全国普通高等学校招生统一考试化学(江苏卷参考版)(已下线)2019年4月8日 《每日一题》三轮复习——反应热的计算与盖斯定律云南省建水县第二中学2020届高三上学期开学考试化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题贵州省麻江县第一中学2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮冲刺新题专练——盖斯定律的应用2海南省海南中学2019-2020学年高二上学期期末考试化学试题福建省厦门市思明区厦门外国语学校2019-2020学年高三上学期周末练习12——化学试题云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题贵州省镇远县二中2019-2020学年高二上学期期末考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题湖南省长沙市第一中学2019-2020学年高一下学期第三次月考化学试题吉林省白城市洮南市第一中学2019-2020学年高一下学期第三次月考化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期期中考试化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题江苏省启东中学2020-2021学年高二上学期期初考试化学试题(已下线)1.3.2 反应热的计算(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)1.3.1 盖斯定律(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测河北省唐山市第十一中学2021届高三9月入学检测化学试题高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)江苏省扬州中学2018-2019学年高二上学期12月月考试题 化学 Word版福建省福州市福清西山学校高中部2019-2020学年高二上学期期中考试化学试题(已下线)【南昌新东方】9.湾里一中 梁莎陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题江苏省徐州市沛县2020-2021学年高二上学期第一次学情调研化学(选修)试题江西省九江市浔阳区九江市第七中学2020-2021学年高二上学期期中考试化学试题(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)山东省曲阜市第一中学2017-2018学年高二上学期第一次月考化学试题湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第一次月考化学试题湖北省十堰市2016-2017学年高一下学期期末调研考试化学试题天津市河东区 2022-2023 学年高二上学期期末质量检测化学试题江苏省盐城市阜宁中学2020-2021学年高二上学期期末考试化学试题江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题江苏省宜兴市张渚高级中学2020-2021学年高二下学期第一学段质量检测化学试题重庆市南开中学2020-2021学年二上学期期末考试化学试题(已下线)第15讲 化学反应的热效应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题湖南省长沙市第一中学、广东省深圳实验学校2021-2022学年高三上学期联考化学试题 (已下线)第14周 晚练题-备战2022年高考化学周测与晚练(新高考专用)河北省保定市徐水综合高级中学2021-2022学年高二上学期第二次月考化学试题湖南省常德市第一中学 2023届高三7月摸底考试化学试题江苏省盐城市第一中学、阜宁中学2021-2022学年高二上学期期中考试化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题河南省安阳市第三十九中学2022-2023学年高二上学期第二次考试化学试题海南省三亚华侨学校(南新校区)2021-2022学年高二上学期期中考试化学试题广东省江门市第一中学2023-2024学年高二上学期第一次段考化学试题江苏省南菁高级中学2023-2024学年高二上学期9月调研化学试题
6 . 以下反应均可制取O2。下列有关说法正确的是
反应①:2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·mol-1
反应②:2H2O2(l)=2H2O(1)+O2(g) △H2=-196.4 kJ·mol-1
反应①:2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·mol-1
反应②:2H2O2(l)=2H2O(1)+O2(g) △H2=-196.4 kJ·mol-1
| A.制取O2的反应一定是吸热反应 |
| B.H2的燃烧热为-571.6 kJ·mol-1 |
| C.若使用催化剂,反应②的△H将减小 |
| D.反应2H2O2(l)=2H2O(g)+O2(g)的△H>-196.4 kJ·mol-1 |
您最近一年使用:0次
2020-08-04更新
|
416次组卷
|
9卷引用:江苏省南通中学2018-2019学年高二上学期期末教学质量调研化学(选修)试题
江苏省南通中学2018-2019学年高二上学期期末教学质量调研化学(选修)试题江苏省徐州市2019-2020学年高二下学期期中抽测化学试题(已下线)第01章 化学反应与能量(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)新疆吾尔自治区石河子第二中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题(已下线)第9单元 化学反应中的能量变化(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷天津市崇化中学2022-2023学年高三上学期期末检测化学试题湖南省郴州市2021-2022学年高二下学期期末考试化学试题黑龙江省大庆市大庆中学2023-2024学年高二下学期开学化学试题
名校
解题方法
7 . 根据热化学方程式S(s)+O2(g)==SO2(g)ΔH=—297.2kJ/mol分析,下列说法中不正确的是
| A.S(s)在O2(g)中燃烧是放热反应 |
| B.16g固体硫在空气中充分燃烧,可放出148.6kJ的热量 |
| C.反应S(g)+O2(g)==SO2(g)的ΔH大于—297.2kJ/mol |
| D.1molSO2(g)所具有的能量小于1molS(s)与1molO2(g)所具有的能量之和 |
您最近一年使用:0次
2020-04-29更新
|
257次组卷
|
5卷引用:山西省吕梁市2019-2020学年高二上学期期末统考化学试题
2019·天津·一模
解题方法
8 . 设NA为阿伏加 德罗常数的值。下列说法中正确的是( )
| A.标况下22.4L HF中电子总数为10NA |
| B.已知CH2═CH2(g)+H2(g) ==== CH3CH3(g)∆H= -137.0 kJ/mol,乙烯与H2加成时放出68.5 kJ热量时,反应过程中被破坏的碳原子之间共用电子对数目为NA |
| C.25℃,1LpH=1的盐酸和1LpH=1的醋酸溶液混合,混合后所得溶液中H+数目为0.2NA(混合后溶液体积变化忽略不计) |
| D.1molICl、1molCl2分别与足量水反应,转移电子数目均为1NA |
您最近一年使用:0次
真题
名校
9 . 已知:2CO(g)+O2(g)=2CO2(g) ΔH=" --" 566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g)ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g)ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

| A.CO的燃烧热为283 kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH< --452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
您最近一年使用:0次
2019-01-30更新
|
1529次组卷
|
18卷引用:2009年普通高等学校招生统一考试理综试题化学部分(天津卷)
2009年普通高等学校招生统一考试理综试题化学部分(天津卷)(已下线)2010年天津市天津一中高三第五次月考(理综)化学部分2009高考真题汇编-化学计算(已下线)北京市门头沟区2010年高三一模(理科综合)化学部分(已下线)2010年安徽师大附中高二第二学期期中考查(已下线)09~10学年浙江舟山七校高二下学期期末考试化学试题(已下线)2010年黑龙江牡丹江一中高二上学期期中考试化学试卷(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷(已下线)2010-2011学年北京市密云二中高二下期3月份月考化学试卷(已下线)2012届浙江省东阳中学高三下学期阶段检测化学试卷(已下线)2011-2012学年安徽省安工大附中、红星中学高二3月联考化学试卷(已下线)2013届吉林省长春外国语学校高三第一次月考化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期中考试化学试卷2015-2016学年江苏省启东中学高二上期中选修化学试卷2016届河南省顶级名校高三上学期期中测试化学试卷【全国百强校】辽宁省鞍山市第一中学2017-2018学年高一下学期期中考试化学试题湖南师大附属颐华学校2022-2023学年高二上学期入学考试化学试题
名校
解题方法
10 . 已知H2(g)+Cl2(g)=2HCl(g) △H= ―184.6kJ·mol-1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为
| A.+184.6kJ·mol-1 | B.-92.3 kJ·mol-1 |
| C.-184.6 kJ·mol-1 | D.+92.3 kJ·mol-1 |
您最近一年使用:0次
2018-11-13更新
|
124次组卷
|
23卷引用:2016-2017学年天津市河东区高二上学期期中质检化学试卷
2016-2017学年天津市河东区高二上学期期中质检化学试卷(已下线)2010年山西省汾阳中学高二上学期第二次月考(化学)(已下线)2011-2012学年吉林省长春外国语学校高二上学期期末考试化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期初考试化学试卷(已下线)2012-2013学年湖北省监利县柘木中学高二第一次月考化学试卷(已下线)2012-2013学年北京市房山区房山中学高二下学期期中考试化学试卷(已下线)2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)2015-2016学年青海省西宁四中高二上学期期末化学试卷四川省邻水实验学校2017-2018学年高二上学期第三次月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题河北省邢台市第八中学2018-2019学年高二上学期期中考试化学试题陕西省黄陵中学高新部2018-2019学年高一第二学期期中考试化学试题陕西省黄陵县中学2018-2019学年高一(重点班)下学期期中考试化学试题广西壮族自治区贺州市桂梧高中2019-2020学年高二上学期第一次月考化学试题陕西省咸阳百灵中学2020-2021学年高二上学期第一次月考化学试题河南省周口市中英文学校2020-2021学年高二上学期第一次月考化学试题广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题贵州省黔西南州同源中学2020-2021学年高二上学期期中教学质量检测化学试题新疆乌鲁木齐市第八中学2019-2020学年高二上学期第三次月考化学试题四川省平昌县驷马中学2020-2021学年下学期高二第一次月考化学试题河南省平顶山市鲁山县第一高级中学2021-2022学年高二上学期10月考试化学试题新疆疏附县第一中学2022-2023学年高二上学期期中考试化学试题吉林省白城市第十四中学2021-2022学年高二上学期期中考试化学试卷题



