名校
解题方法
1 . 一定条件下,氢气与氧气反应的能量变化如图所示,下列说法中正确的是


A.该反应的反应热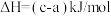 |
| B.该反应为吸热反应 |
C.断裂2molH-H和1mol 放出(b-a)KJ的能量 放出(b-a)KJ的能量 |
D. 燃烧热的热化学方程式为: 燃烧热的热化学方程式为: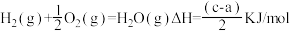 |
您最近一年使用:0次
2021-07-14更新
|
2078次组卷
|
15卷引用:山东省新泰市第二中学2021-2022学年上学期高二阶段性测试(一)化学试题
山东省新泰市第二中学2021-2022学年上学期高二阶段性测试(一)化学试题贵州省遵义市2020~2021学年高二下学期期末质量检测化学试题(已下线)1.1.2 热化学方程式-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)宁夏银川市第六中学2021-2022学年高二上学期第一次月考化学试题黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省永昌县第一高级中学2021-2022学年高二上学期期末考试化学试题辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题新疆乌鲁木齐市第四中学2021-2022学年高二上学期期末考试化学试题湖北省红安县第一中学2022-2023学年高二上学期9月考试化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题云南省昆明市寻甸县第二中学2022-2023学年高二上学期10月月考 化学试卷西藏昌都市第三高级中学2021-2022学年高二上学期期中考试化学试题
2 . 回答下列问题:
(1)一定条件下,由稳定单质反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。图为VIA族元素氢化物a、b、c、d的生成热数据示意图。

①非金属元素氢化物的稳定性与氢化物的生成热△H的关系为_______ 。
②硫化氢发生分解反应的热化学方程式为_______ 。
(2)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1
b)CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
c)CH4(g) C(s)+2H2(g) △H3
C(s)+2H2(g) △H3
d)2CO(g) CO2(g)+C(s) △H4
CO2(g)+C(s) △H4
e)CO(g)+H2(g) H2O(g)+C(s) △H5
H2O(g)+C(s) △H5
根据盖斯定律,反应a的△H1=_______ (写出一个代数式即可)
(3)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25°C时,相关物质的燃烧热数据如表:
则25°C时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为_______ 。
(4)已知5C2H4(g)+12MnO (aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为_______ (用含m、n的代数式表示)
(1)一定条件下,由稳定单质反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。图为VIA族元素氢化物a、b、c、d的生成热数据示意图。

①非金属元素氢化物的稳定性与氢化物的生成热△H的关系为
②硫化氢发生分解反应的热化学方程式为
(2)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2c)CH4(g)
 C(s)+2H2(g) △H3
C(s)+2H2(g) △H3d)2CO(g)
 CO2(g)+C(s) △H4
CO2(g)+C(s) △H4e)CO(g)+H2(g)
 H2O(g)+C(s) △H5
H2O(g)+C(s) △H5根据盖斯定律,反应a的△H1=
(3)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25°C时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热△H(kJ·mol-1) | -285.8 | -393.5 | -3267.5 |
(4)已知5C2H4(g)+12MnO
 (aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) △H=-m kJ·mol-1,当放出的热量为n kJ时,该反应转移的电子数为
您最近一年使用:0次
3 . 已知25℃、101kPa下,1mol水蒸发为水蒸气需要吸热44.0kJ
①H+(aq)+OH-(aq)=H2O(l)△H1=-57.3kJ•mol-1
②2CH3OH(l)+3O2(g)=4H2O(g)+2CO2(g)△H2=-1277.0kJ•mol-1
下列有关说法错误的是
①H+(aq)+OH-(aq)=H2O(l)△H1=-57.3kJ•mol-1
②2CH3OH(l)+3O2(g)=4H2O(g)+2CO2(g)△H2=-1277.0kJ•mol-1
下列有关说法错误的是
| A.若反应②中CH3OH变为气态,则该反应的反应热△H>△H2 |
| B.CH3OH(l)的燃烧热△H=-726.5kJ•mol-1 |
| C.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H>﹣57.3kJ•mol-1 |
| D.液态水变为水蒸气过程中需要克服分子间作用力 |
您最近一年使用:0次
2021-04-13更新
|
637次组卷
|
6卷引用:押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)河北省秦皇岛市2021届普通高中学业水平选择性考试第二次模拟演练化学试题(已下线)第17讲 化学能与热能(精讲)-2022年一轮复习讲练测河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题(已下线)第03讲 盖斯定律(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)江西省九校2022-2023学年高二下学期开学联考化学试题
11-12高二上·福建福州·阶段练习
名校
解题方法
4 . 分析表中的四个热化学方程式,判断氢气和丙烷的标准燃烧热分别是
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ∙mol-1 ②2H2(l)+O2(l)=2H2O(g) ΔH=-482.6kJ∙mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2013.8kJ∙mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2221.5kJ∙mol-1 |
| A.-571.6kJ∙mol-1,-2221.5kJ∙mol-1 | B.-285.5kJ∙mol-1,-2013.8kJ∙mol-1 |
| C.-285.8kJ∙mol-1,-2221.5kJ∙mol-1 | D.-241.3kJ∙mol-1,-2013.8kJ∙mol-1 |
您最近一年使用:0次
2021-03-17更新
|
541次组卷
|
20卷引用:2015-2016学年山东省淄博市淄川一中等三校高二上期末联考化学试卷
2015-2016学年山东省淄博市淄川一中等三校高二上期末联考化学试卷(已下线)2011-2012年福建省福州市罗源一中高二上学期第一次月考化学试卷(已下线)2014届甘肃省天水市秦安县高三上学期期末检测化学试卷(已下线)2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学(已下线)2015安徽望江中学同步课时练(人教选修4)第一章检测试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷2015-2016学年云南省昆明三中高二下期中化学试卷2016-2017学年陕西省西安中学高二上10月月考化学试卷贵州省遵义市航天高级中学2018-2019学年高二(理)上学期第一次月考化学试题【全国百强校】贵州省遵义航天高级中学2018-2019学年高二上学期第一次月考化学试题四川省成都七中实验学校2018-2019学年高二上学期10月月考化学试题吉林省东辽五中2019-2020学年高二上学期9月月考化学试题江西省赣州市赣县第三中学2020-2021学年高二上学期9月入学考试化学试题(重点班)吉林省辽源市田家炳高级中学校2020-2021学年高二上学期第一次月考化学试题安徽省六安市舒城育才学校2020-2021学年高二上学期期末考试化学试题(已下线)1.2 燃烧热 能源-2021-2022学年高二化学课后培优练(人教版选修4)陕西省泾阳县2020-2021学年高二上学期期中考试化学试题(已下线)1.1.2 热化学方程式 燃烧热(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
12-13高一下·山东济宁·阶段练习
名校
5 . 航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式为N2H4+2H2O2=N2↑+4H2O。下列说法中错误的是 ( )
| A.肼(N2H4)分子中只存在极性共价键 |
| B.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
| C.该反应中肼作还原剂 |
| D.该反应的反应物总能量高于生成物的总能量 |
您最近一年使用:0次
2019-06-10更新
|
996次组卷
|
11卷引用:2012-2013学年山东省济宁市任城一中高一3月质量检测化学试卷
(已下线)2012-2013学年山东省济宁市任城一中高一3月质量检测化学试卷2014-2015四川省大竹县文星中学高一4月月考化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期中考试化学试题湖南省双峰县第一中学2017-2018学年高二上期第一次月考化学试题【全国市级联考】湖南省五市十校2018年上学期高一期中考试化学试题河南省周口市扶沟县高级中学2018-2019学年高一下学期第一次月考化学试题【全国百强校】宁夏回族自治区银川一中2018-2019学年高一下学期期中考试化学试题高一必修第二册(人教2019版)第六章 第一节 化学反应与能量变化 课时1 化学反应与能量变化(已下线)6.1.1 化学反应与热能(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)甘肃省静宁县第一中学2020-2021学年高一下学期第一次月考化学(实)试题河南省信阳市2021-2022学年高一下学期期中教学质量检测化学试题
名校
解题方法
6 . 已知CH4(g)、CO(g)和H2(g)的摩尔燃烧焓(△H)分别为—890.3kJ•mol-1、—283.0kJ•mol-1和—285.8kJ•mol-1,氢气与氧气反应生成气态水和液态水的热效应如图所示,下列有关说法正确的是
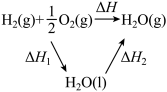

| A.反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=—237.3kJ•mol-1 |
| B.1molCH4(g)充分燃烧生成CO2(g)和气态水,放出的热量为890.3kJ—2△H2 |
| C.当氢氧燃料电池负极消耗1mol氢气时,可释放的电能小于285.8kJ |
| D.图示过程中△H=△H1-△H2 |
您最近一年使用:0次
2023-04-29更新
|
255次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
名校
解题方法
7 . 常温常压下,3.2g甲醇完全燃烧生成CO2和液态水时放热72.58kJ,甲醇燃烧热的热化学方程式为( )
A.CH3OH(1)+ O2(g)=CO2(g)+2H2O(1) ΔH=+725.8kJ·mol-1 O2(g)=CO2(g)+2H2O(1) ΔH=+725.8kJ·mol-1 |
| B.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) ΔH=-725.8kJ·mol-1 |
C.CH3OH(1)+ O2(g)=CO2(g)+2H2O(1) ΔH=-725.8kJ·mol-1 O2(g)=CO2(g)+2H2O(1) ΔH=-725.8kJ·mol-1 |
| D.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) ΔH=-1451.6kJ·mol-1 |
您最近一年使用:0次
2022-10-16更新
|
325次组卷
|
7卷引用:山东省济南市2022-2023学年高二上学期10月份质量检测联合调考化学试题
名校
8 . 利用CO2(g)与H2(g)反应生成CH3OCH3(g)和H2O(g)有利于实现碳中和,其反应过程中的能量变化如图所示。下列有关说法正确的是
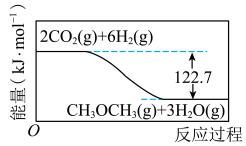

| A.若该反应在绝热密闭容器中进行,则反应过程中体系温度会降低 |
| B.1 molH2(g)在O2(g)中完全燃烧生成H2O(g)时放出的热量大于20.45kJ |
| C.若反应消耗0.4 molCO2(g)和1.2molH2(g),则该反应放出49.08kJ热量 |
| D.CH3OCH3(g)+3H2O(g)=2CO2(g) +6H2(g) ∆H=-122.7 kJ·mol-1 |
您最近一年使用:0次
2023-10-17更新
|
154次组卷
|
2卷引用:山东学情2023-2024学年高二上学期10月质量检测(鲁科版)化学试题
9 . 下列依据热化学方程式得出的结论正确的是
A.若  ,则 ,则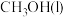 的燃烧热为 的燃烧热为 |
B.若  ,则红磷比白磷稳定 ,则红磷比白磷稳定 |
C.已知  ,则 ,则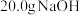 固体与稀盐酸完全中和,放出 固体与稀盐酸完全中和,放出 的热量 的热量 |
D.已知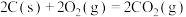  , ,  ,则 ,则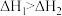 |
您最近一年使用:0次
2021-01-10更新
|
523次组卷
|
7卷引用:山东省鄄城县第一中学2022-2023学年高一下学期3月月考化学试题
13-14高二上·河南漯河·期中
名校
10 . 已知下列两个热化学方程式:
2H2(g)+O2(g)==2H2O(l) △H =-571.6kJ•mol-1
C3H8(g) +5O2(g)==3CO2(g) +4H2O(l) △H=-2220.0kJ•mol-1
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是( )
2H2(g)+O2(g)==2H2O(l) △H =-571.6kJ•mol-1
C3H8(g) +5O2(g)==3CO2(g) +4H2O(l) △H=-2220.0kJ•mol-1
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是( )
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
您最近一年使用:0次
2019-10-05更新
|
428次组卷
|
17卷引用:2015-2016学年山东省桓台二中高二下期末化学试卷
2015-2016学年山东省桓台二中高二下期末化学试卷(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2014秋季湖南省浏阳一中高二上学期第一次阶段测试化学(B)试题2014-2015学年云南省富民县一中高二上学期期中化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2016-2017学年天津市河东区高二上学期期中质检化学试卷陕西省西安市电子科技中学2017-2018学年高二上学期第一次月考化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题广东省深圳市耀华实验学校2018-2019学年高二上学期第一次月考化学试题甘肃省武威第一中学2019-2020学年高二10月月考化学试题江西省南城县第二中学2018-2019学年高二上学期第二次月考化学试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题(已下线)专题讲座(一) 化学计算的常用方法(精讲)-2022年一轮复习讲练测河北省藁城新冀明中学2021-2022学年高二上学期10月月考化学试题(已下线)专题讲座(一) 化学计算的常用方法(讲)-2023年高考化学一轮复习讲练测(全国通用)



