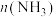解题方法
1 . I.含碳化合物甲烷、 等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
(1)一种甲烷催化氧化的反应历程如图所示,“*”表示微粒吸附在催化剂表面。下列叙述错误的是___________(填标号)。
Ⅱ.以氧化铟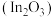 作催化剂,可实现
作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。
已知:ⅰ.催化剂活化: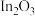 (无活性)
(无活性)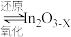 (有活性);
(有活性);
ⅱ. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
反应①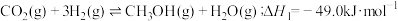
反应②
反应③: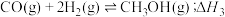
(2)反应③中
___________ 。
(3)工业上以原料气通过催化剂表面的方法生产甲醇, 是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:
是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:___________ 。为了减少催化剂的失活,可以采用的方法是___________ 。
(4)按 时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在t=250℃条件下的
,在t=250℃条件下的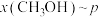 、在
、在 条件下的
条件下的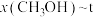 (温度)如图所示。
(温度)如图所示。___________ (填“a”或“b”),判断理由是___________ 。
ii.A、B、C、D、E、F中可能表示220℃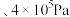 时的平衡状态的点是
时的平衡状态的点是___________ 。
(5)将 和
和 按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
反应①的速率可表示为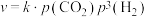 (
( 为常数),平衡时
为常数),平衡时 ,已知在
,已知在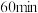 时
时 的转化率为
的转化率为 ,则反应①的正向反应在
,则反应①的正向反应在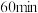 时的
时的
___________ (用含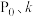 的式子表示)。
的式子表示)。
 等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:(1)一种甲烷催化氧化的反应历程如图所示,“*”表示微粒吸附在催化剂表面。下列叙述错误的是___________(填标号)。
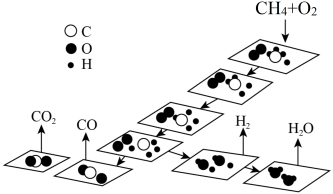
A.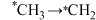 的过程中,放出能量 的过程中,放出能量 |
| B.产物从催化剂表面脱附的速率慢会降低总反应速率 |
C.适当提高 分压会降低 分压会降低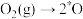 的反应速率 的反应速率 |
D. 与 与 反应生成 反应生成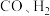 均涉及极性键、非极性键的断裂和生成 均涉及极性键、非极性键的断裂和生成 |
Ⅱ.以氧化铟
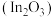 作催化剂,可实现
作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。已知:ⅰ.催化剂活化:
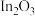 (无活性)
(无活性)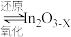 (有活性);
(有活性);ⅱ.
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:反应①
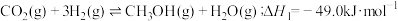
反应②

反应③:
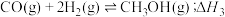
(2)反应③中

(3)工业上以原料气通过催化剂表面的方法生产甲醇,
 是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:
是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:(4)按
 时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在t=250℃条件下的
,在t=250℃条件下的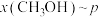 、在
、在 条件下的
条件下的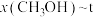 (温度)如图所示。
(温度)如图所示。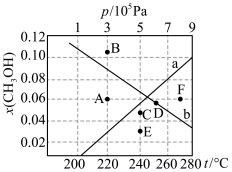
ii.A、B、C、D、E、F中可能表示220℃
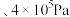 时的平衡状态的点是
时的平衡状态的点是(5)将
 和
和 按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:| 时间/min | 0 | 20 | 40 | 60 | 80 |
| 压强/MPa |  | 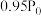 | 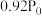 |  |  |
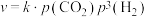 (
( 为常数),平衡时
为常数),平衡时 ,已知在
,已知在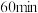 时
时 的转化率为
的转化率为 ,则反应①的正向反应在
,则反应①的正向反应在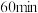 时的
时的
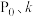 的式子表示)。
的式子表示)。
您最近半年使用:0次
解题方法
2 . 一氧化碳和氮的氧化物都是大气污染物,如何有效处理它们是科学家长期研究的课题.
(1)CO还原 的反应为:
的反应为:
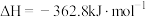 .
.
①研究者发现在气相中 催化CO与
催化CO与 反应的历程有两步:
反应的历程有两步:
第一步:
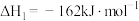
则第二步的热化学方程式为________________ ;
②在恒温恒容密闭容器中,反应一段时间后,以下能说明反应达到平衡状态的是________ (填字母);
A. B.混合气体的密度保持不变
B.混合气体的密度保持不变
C. 的体积分数保持不变 D.容器的压强保持不变
的体积分数保持不变 D.容器的压强保持不变
(2)在密闭容器中发生反应: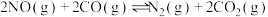
 .一段时间后达到平衡;
.一段时间后达到平衡;
①恒温恒压下,再向该容器中注入氩气,NO的平衡转化率煘小,其原因是________ ;
②一定温度下,在 恒容密闭容器中,加入
恒容密闭容器中,加入 和
和 各
各 ,反应过程中部分物质的体积分数(
,反应过程中部分物质的体积分数( )随时间(t)的变化如图1所示.曲线b代表的是
)随时间(t)的变化如图1所示.曲线b代表的是________ (填化学式)体积分数随时间的变化: 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为________  ;该温度下的平衡常数为
;该温度下的平衡常数为________  ;
;
①a电极的电极反应式为________________ ;
②电池工作一段时间,反应消耗了标准状况下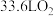 ,理论上负极区溶液增加的质量为
,理论上负极区溶液增加的质量为________ g。
(1)CO还原
 的反应为:
的反应为:
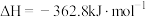 .
.①研究者发现在气相中
 催化CO与
催化CO与 反应的历程有两步:
反应的历程有两步:第一步:

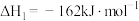
则第二步的热化学方程式为
②在恒温恒容密闭容器中,反应一段时间后,以下能说明反应达到平衡状态的是
A.
 B.混合气体的密度保持不变
B.混合气体的密度保持不变C.
 的体积分数保持不变 D.容器的压强保持不变
的体积分数保持不变 D.容器的压强保持不变(2)在密闭容器中发生反应:
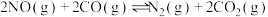
 .一段时间后达到平衡;
.一段时间后达到平衡;①恒温恒压下,再向该容器中注入氩气,NO的平衡转化率煘小,其原因是
②一定温度下,在
 恒容密闭容器中,加入
恒容密闭容器中,加入 和
和 各
各 ,反应过程中部分物质的体积分数(
,反应过程中部分物质的体积分数( )随时间(t)的变化如图1所示.曲线b代表的是
)随时间(t)的变化如图1所示.曲线b代表的是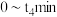 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为 ;该温度下的平衡常数为
;该温度下的平衡常数为 ;
; 
①a电极的电极反应式为
②电池工作一段时间,反应消耗了标准状况下
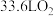 ,理论上负极区溶液增加的质量为
,理论上负极区溶液增加的质量为
您最近半年使用:0次
名校
3 . 25℃下,分别向体积均为1L的容器甲(恒温)、容器乙(绝热)中加入2molA和2molB,发生反应 ,两容器中A的转化率随时间的变化如图.下列说法正确的是
,两容器中A的转化率随时间的变化如图.下列说法正确的是
 ,两容器中A的转化率随时间的变化如图.下列说法正确的是
,两容器中A的转化率随时间的变化如图.下列说法正确的是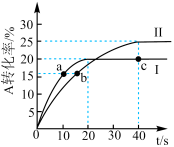
A.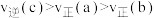 |
| B.曲线Ⅰ代表容器乙中A的转化率随时间变化 |
C.0~40s内,曲线Ⅱ中C的反应速率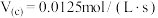 |
| D.容器乙达平衡后,缩小容器体积,达新平衡后C的物质的量增大 |
您最近半年使用:0次
解题方法
4 . 金属氧化物催化氧化制备苯甲醛是近年来的研究热点。以 为催化剂,苯乙烯、
为催化剂,苯乙烯、 为原料制备苯甲醛涉及的主要反应有:
为原料制备苯甲醛涉及的主要反应有:
(1)反应iii的
_______  。
。
(2)根据阿累尼乌斯方程 (A为指前因子,
(A为指前因子, 为活化能),
为活化能),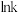 与
与 呈线性关系。据图1可知反应i的活化能
呈线性关系。据图1可知反应i的活化能_______ 反应ⅱ的活化能。(填“>”“=”或“<”) ,苯乙烯的转化率下降,可能的原因是
,苯乙烯的转化率下降,可能的原因是_______ 。

(4) 的催化反应机理如下图所示:
的催化反应机理如下图所示:_______ 。(填序号)
(5)在 催化下,甲苯可以实现气相氧化制备苯甲醛。
催化下,甲苯可以实现气相氧化制备苯甲醛。
(8)
 时,向
时,向 密闭容器中充入
密闭容器中充入 甲苯蒸气和
甲苯蒸气和 ,起始压强为
,起始压强为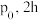 后反应达平衡时容器内气体总物质的量为
后反应达平衡时容器内气体总物质的量为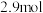 ,甲苯的转化率为
,甲苯的转化率为 。则甲苯的平均反应速率为
。则甲苯的平均反应速率为_______  ,主反应的
,主反应的
_______ ( 为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
 为催化剂,苯乙烯、
为催化剂,苯乙烯、 为原料制备苯甲醛涉及的主要反应有:
为原料制备苯甲醛涉及的主要反应有:反应i: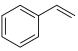 (l)+2H2O2(l)→
(l)+2H2O2(l)→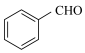 (l)+HCHO(l)+2H2O(l)
(l)+HCHO(l)+2H2O(l)
反应ii: (l)+H2O2(l)→
(l)+H2O2(l)→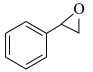 (l)+H2O(l)
(l)+H2O(l)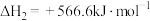
反应iii: (l)+H2O2(l)→
(l)+H2O2(l)→ (l)+HCHO(l)+H2O(l)
(l)+HCHO(l)+H2O(l)
(1)反应iii的

 。
。(2)根据阿累尼乌斯方程
 (A为指前因子,
(A为指前因子, 为活化能),
为活化能),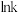 与
与 呈线性关系。据图1可知反应i的活化能
呈线性关系。据图1可知反应i的活化能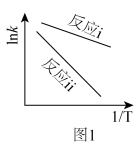
 ,苯乙烯的转化率下降,可能的原因是
,苯乙烯的转化率下降,可能的原因是
(4)
 的催化反应机理如下图所示:
的催化反应机理如下图所示:
(5)在
 催化下,甲苯可以实现气相氧化制备苯甲醛。
催化下,甲苯可以实现气相氧化制备苯甲醛。(6)主反应: +O2→
+O2→ +H2O
+H2O
副反应:2 +O2→2
+O2→2
(8)
 时,向
时,向 密闭容器中充入
密闭容器中充入 甲苯蒸气和
甲苯蒸气和 ,起始压强为
,起始压强为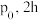 后反应达平衡时容器内气体总物质的量为
后反应达平衡时容器内气体总物质的量为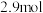 ,甲苯的转化率为
,甲苯的转化率为 。则甲苯的平均反应速率为
。则甲苯的平均反应速率为 ,主反应的
,主反应的
 为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
您最近半年使用:0次
解题方法
5 . 乙醇因其含氢量高、毒性低、价格低廉且来源广泛,成为理想的液态储氢载体之一。乙醇―水催化重整可获得 ,其主要反应为:
,其主要反应为:
Ⅰ.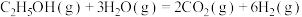

Ⅱ.

回答下列问题:
(1)已知:298K时,相关物质的相对能量如下表:
则a=___________ 。
(2)在恒温恒容条件下,投入1mol 和3mol
和3mol 发生反应
发生反应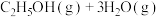
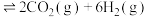 ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。
(3)科学家研究了Grubbs催化剂作用于乙醇水溶液重整产氢的反应,测得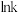 (k为速率常数)与反应温度倒数(
(k为速率常数)与反应温度倒数( )的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:
)的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:___________ 。 下,
下,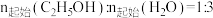 时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时
时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图2所示。
的产率随温度的变化如图2所示。 的选择性
的选择性
①图中表示 产率随温度变化的曲线是
产率随温度变化的曲线是___________ (填字母),判断依据是___________ 。
②一定温度下,加入 可以提高平衡时
可以提高平衡时 的产率,其原因是
的产率,其原因是___________ 。
(5)向一容积为2L的恒容密闭容器中通入2mol 和6mol
和6mol ,一定温度下发生反应
,一定温度下发生反应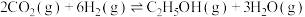 。若起始时气体的总压为p Pa,20min时达到平衡状态,测得
。若起始时气体的总压为p Pa,20min时达到平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时气体的总压为___________ Pa(用含p的分数表示,需化简)。
②0~20min内,用 浓度的变化表示的平均反应速率
浓度的变化表示的平均反应速率
___________ ;该温度下,上述反应的平衡常数
___________ 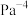 (用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 ,其主要反应为:
,其主要反应为:Ⅰ.
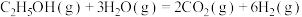

Ⅱ.


回答下列问题:
(1)已知:298K时,相关物质的相对能量如下表:
| 物质 |  |  |  |  |  |
相对能量/( ) ) | ―242 | ―393 | 0 | ―110 | a |
(2)在恒温恒容条件下,投入1mol
 和3mol
和3mol 发生反应
发生反应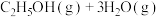
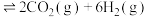 ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。| A.混合气体的密度保持不变 | B.混合气体的总压强保持不变 |
| C.混合气体的平均摩尔质量保持不变 | D.产物的浓度之比保持不变 |
(3)科学家研究了Grubbs催化剂作用于乙醇水溶液重整产氢的反应,测得
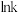 (k为速率常数)与反应温度倒数(
(k为速率常数)与反应温度倒数( )的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:
)的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系: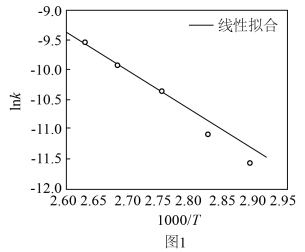
 下,
下,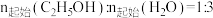 时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时
时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图2所示。
的产率随温度的变化如图2所示。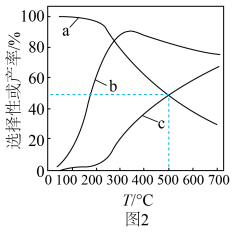
 的选择性
的选择性
①图中表示
 产率随温度变化的曲线是
产率随温度变化的曲线是②一定温度下,加入
 可以提高平衡时
可以提高平衡时 的产率,其原因是
的产率,其原因是(5)向一容积为2L的恒容密闭容器中通入2mol
 和6mol
和6mol ,一定温度下发生反应
,一定温度下发生反应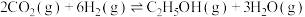 。若起始时气体的总压为p Pa,20min时达到平衡状态,测得
。若起始时气体的总压为p Pa,20min时达到平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时气体的总压为
②0~20min内,用
 浓度的变化表示的平均反应速率
浓度的变化表示的平均反应速率

 (用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近半年使用:0次
6 . 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图示:________ 。
(2)若上述反应中X、Y、Z分别为 、
、 、
、 ,某温度下,在容积恒定为2.0L的密闭容器中充入
,某温度下,在容积恒定为2.0L的密闭容器中充入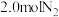 和
和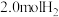 ,一段时间后反应达平衡状态,实验数据如表所示:
,一段时间后反应达平衡状态,实验数据如表所示:
0~50s内的平均反应速率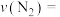
________ 。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成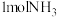 过程中放出46kJ的热量。则N≡N的键能为
过程中放出46kJ的热量。则N≡N的键能为________ kJ/mol。
(4)CO与 反应可制备
反应可制备 ,由
,由 和
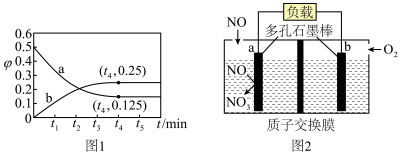
和 构成的质子交换膜燃料电池的结构示意图如下。
构成的质子交换膜燃料电池的结构示意图如下。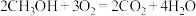 ,则c电极是
,则c电极是________ (填“正极”或“负极”)。若外电路中转移2mol电子,则上述燃料电池所消耗的 在标准状况下的体积为
在标准状况下的体积为________ L。
(5)下列反应中,属于吸热反应的是________ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败
⑥ 与
与 反应 ⑦铁粉与稀盐酸反应
反应 ⑦铁粉与稀盐酸反应

(2)若上述反应中X、Y、Z分别为
 、
、 、
、 ,某温度下,在容积恒定为2.0L的密闭容器中充入
,某温度下,在容积恒定为2.0L的密闭容器中充入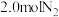 和
和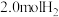 ,一段时间后反应达平衡状态,实验数据如表所示:
,一段时间后反应达平衡状态,实验数据如表所示:t/s | 0 | 50 | 150 | 250 | 350 |
| 0 | 0.36 | 0.48 | 0.50 | 0.50 |
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成
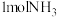 过程中放出46kJ的热量。则N≡N的键能为
过程中放出46kJ的热量。则N≡N的键能为(4)CO与
 反应可制备
反应可制备 ,由
,由 和
和 构成的质子交换膜燃料电池的结构示意图如下。
构成的质子交换膜燃料电池的结构示意图如下。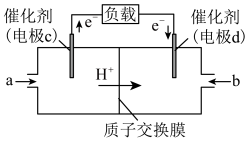
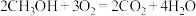 ,则c电极是
,则c电极是 在标准状况下的体积为
在标准状况下的体积为(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败
⑥
 与
与 反应 ⑦铁粉与稀盐酸反应
反应 ⑦铁粉与稀盐酸反应
您最近半年使用:0次
名校
解题方法
7 . 湖北省十堰地区发现大量铌、钽等稀土矿产。萃取剂P204用于萃取稀土金属铌的反应为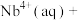
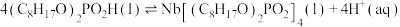 。某温度下,萃取铌离子的溶液中
。某温度下,萃取铌离子的溶液中 与时间变化关系如图所示。
与时间变化关系如图所示。
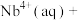
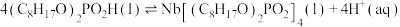 。某温度下,萃取铌离子的溶液中
。某温度下,萃取铌离子的溶液中 与时间变化关系如图所示。
与时间变化关系如图所示。
A.其他条件不变, 时萃取反应已停止 时萃取反应已停止 |
B. 增大,萃取平衡向左移动,平衡常数减小 增大,萃取平衡向左移动,平衡常数减小 |
C.萃取反应的正反应速率: |
D. 段 段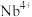 平均反应速率 平均反应速率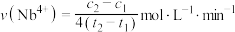 |
您最近半年使用:0次
7日内更新
|
107次组卷
|
3卷引用:湖北省T8联盟2024届高三下学期压轴考试(二模)化学试题
解题方法
8 . 人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为:CO2+3H2 CH3OH+H2O ∆H1。回答下列问题:
CH3OH+H2O ∆H1。回答下列问题:
(1)已知:①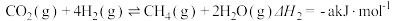
②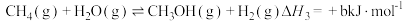
③ 均为大于零的数,且
均为大于零的数,且

___________  (用含
(用含 、
、 的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含
的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含 )电极反应式为
)电极反应式为___________ 。
(2)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应的最佳催化剂为___________ (填化学式)。 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。___________ 。
②结合上图及学过的知识推测,有水参与的历程,反应速率加快的原因是___________ 。
(4)在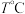 时,将
时,将 和
和 充入容积为
充入容积为 的恒容容器中,只发生
的恒容容器中,只发生 ,测得体系中剩余
,测得体系中剩余 的物质的量随时间变化如图中状态Ⅰ所示。
的物质的量随时间变化如图中状态Ⅰ所示。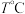 时,
时,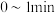 内甲醇的反应速率
内甲醇的反应速率
___________ 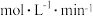 。
。
②该反应的平衡常数表达式为___________ 。
③保持投料量不变,仅改变某一个条件后,测得 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是___________ 。
 CH3OH+H2O ∆H1。回答下列问题:
CH3OH+H2O ∆H1。回答下列问题:(1)已知:①
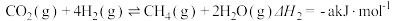
②
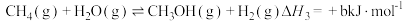
③
 均为大于零的数,且
均为大于零的数,且

 (用含
(用含 、
、 的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含
的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含 )电极反应式为
)电极反应式为(2)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应的最佳催化剂为
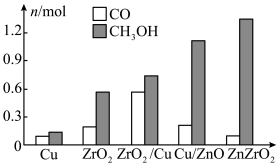
 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。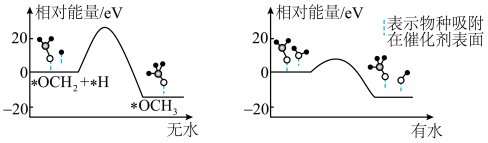
②结合上图及学过的知识推测,有水参与的历程,反应速率加快的原因是
(4)在
 时,将
时,将 和
和 充入容积为
充入容积为 的恒容容器中,只发生
的恒容容器中,只发生 ,测得体系中剩余
,测得体系中剩余 的物质的量随时间变化如图中状态Ⅰ所示。
的物质的量随时间变化如图中状态Ⅰ所示。
 时,
时,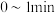 内甲醇的反应速率
内甲醇的反应速率
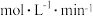 。
。②该反应的平衡常数表达式为
③保持投料量不变,仅改变某一个条件后,测得
 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
您最近半年使用:0次
名校
解题方法
9 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。
 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:
Ⅰ.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
①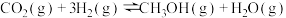
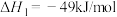
②
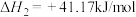
③

(1)反应③中活化能
__________ (填“>”或“<”)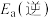 。
。
(2)在催化剂作用下,按 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示: 。
。
①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因__________ ,在实际工业生产中压强不能过高也不能过低的原因是____________ 。
② 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=__________ MPa,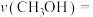
__________ MPa/min,反应②的
__________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
Ⅱ.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: ,则该电极反应式为
,则该电极反应式为____________________ 。

 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:Ⅰ.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
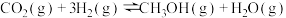
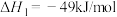
②

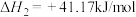
③


(1)反应③中活化能

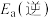 。
。(2)在催化剂作用下,按
 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
 。
。①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因
②
 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=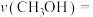

 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。Ⅱ.近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: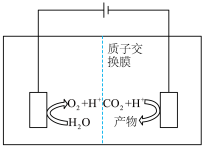
 ,则该电极反应式为
,则该电极反应式为
您最近半年使用:0次
10 . 用 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:
(1)利用 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为_____ 。
写出 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:_____ 。
(3)一定条件下,向某恒容密闭容器中充入2
 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。_____ 。
② K时,该反应的平衡常数
K时,该反应的平衡常数
_____ (列出计算式即可,不必化简。以分压代替浓度,分压=总压×物质的量分数)。
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:
该反应速率的通式为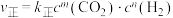 ,
,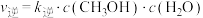 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中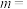
_____ 、
_____ 。实验发现,当实验1中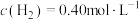 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的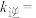
_____ 。
 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:(1)利用
 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为
| 共价键 |  |  |  |  |  |
键能/( ) ) | 464 | 358 | 799 | 432 | 411 |
 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:(3)一定条件下,向某恒容密闭容器中充入2

 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。
②
 K时,该反应的平衡常数
K时,该反应的平衡常数
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入
 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:| 实验 | 起始浓度/( ) ) | 初始速率/( ) ) | |
 |  | ||
| 1 | 0.25 | 1.00 | 0.45 |
| 2 | 0.25 | 2.00 | 3.60 |
| 3 | 2.00 | 1.00 | 3.6 |
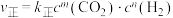 ,
,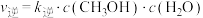 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中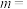

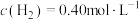 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的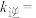
您最近半年使用:0次