名校
1 . 已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。某化学小组欲探究H2C2O4溶液和酸性KMnO4溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略混合时溶液体积变化):
下列说法不正确的是
| 编号 | 0.01mol·L-1酸性KMnO4溶液体积/mL | 0.1mol·L-1H2C2O4溶液体积/mL | 水的体积/mL | 反应温度/℃ | 反应时间/min |
| Ⅰ | 2 | 2 | 0 | 20 | 2.1 |
| Ⅱ | V1 | 2 | 1 | 20 | 5.5 |
| Ⅲ | V2 | 2 | 0 | 50 | 0.5 |
| A.V1=1,V2=2 |
| B.实验计时是从溶液混合开始,溶液呈紫红色时结束 |
| C.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响 |
| D.实验Ⅲ中用酸性KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=0.02mol·L-1·min-1 |
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.铁是生产生活、科学研究中的重要物质,研究与Fe相关的反应时要关注反应的快慢和程度,某些有铁参与的反应可设计成原电池。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式_______ 。
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_____ v逆(CO2)(填“>”“<”或“=”)。
(4)0~4min内, CO的平均反应速率v(CO)=____ 。
(5)仅改变下列条件,化学反应速率减小的是___ (填字母)。
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。___ 极(填“正”或“负”),。
(7)写出b电极上的电极反应式______ 。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
A. | B.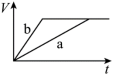 |
C.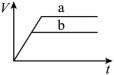 | D.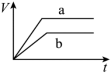 |
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
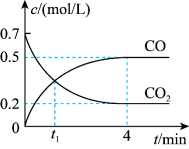
(4)0~4min内, CO的平均反应速率v(CO)=
(5)仅改变下列条件,化学反应速率减小的是
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。
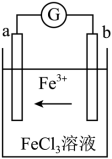
(7)写出b电极上的电极反应式
您最近一年使用:0次
名校
解题方法
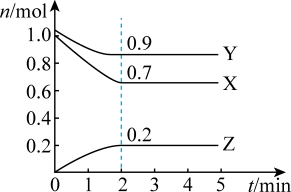
3 . 某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论正确的是

| A.该反应的化学方程式为2Z+Y = 3X |
| B.3min 时,正、逆反应都不再继续进行,反应达到化学平衡 |
| C.反应到3min时,容器中的反应完成程度达到了最大 |
| D.温度、体积不变,3min 时充入1 mol He使压强增大,正逆反应速率都增大 |
您最近一年使用:0次
名校
4 . 科学家研究利用反应 处理污染气体,向两个体积相同的恒容密闭容器中分别通入
处理污染气体,向两个体积相同的恒容密闭容器中分别通入 和
和 发生反应,反应体系的总压强随时间变化如图所示。下列说法正确的是
发生反应,反应体系的总压强随时间变化如图所示。下列说法正确的是
 处理污染气体,向两个体积相同的恒容密闭容器中分别通入
处理污染气体,向两个体积相同的恒容密闭容器中分别通入 和
和 发生反应,反应体系的总压强随时间变化如图所示。下列说法正确的是
发生反应,反应体系的总压强随时间变化如图所示。下列说法正确的是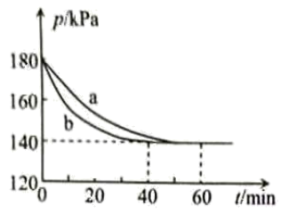
| A.b中反应温度比a中反应温度更高 |
B.向平衡后的b中加入 和 和 ,平衡向逆向移动 ,平衡向逆向移动 |
C.a中, 内 内 的平均反应速率约为 的平均反应速率约为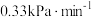 |
D.若开始时将b容积压缩到一半,则b平衡时总压大于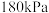 |
您最近一年使用:0次
名校
5 . 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,以气体Z表示的平均反应速率为___________ 。1min时,正反应速率___________ (填“>”“<”或“=”)逆反应速率。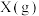 的平衡转化率为
的平衡转化率为___________ 。
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
(4)反应开始至2min末,以气体X表示的平均反应速率为___________ ;反应开始时与反应达平衡状态时的压强之比为___________ 。
(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
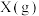 的平衡转化率为
的平衡转化率为(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
| A.①②⑤ | B.①③④ | C.②③④ | D.③④⑤ |
(4)反应开始至2min末,以气体X表示的平均反应速率为
您最近一年使用:0次
解题方法
6 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为 和
和 ),其反应的化学方程式为
),其反应的化学方程式为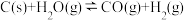 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是___________。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是___________ 。
A.充入He使容器压强增大,能提高反应速率
B.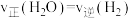 ,说明反应达到平衡状态
,说明反应达到平衡状态
C.容器中焦炭的质量不再变化,说明反应达到平衡状态
D.混合气体的密度不再发生改变时,反应达平衡状态
E.升高温度,能使正反应速率增大,逆反应速率减小
(3)298K时,1gH2燃烧生成H2O(g)放热121kJ,1molH2O(l)蒸发吸热44kJ,表示H2燃烧热的热化学方程式为___________ 。
(4)恒温下,将1molN2和3molH2置于体积为2L的密闭容器中进行反应N2+3H2⇌2NH3,若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为___________ ,N2的转化率为___________ ,欲提高合成氨的反应速率可采取的措施为___________ 。(任意答2点)
(5)工业制备硝酸过程中,通常对氨气进行催化氧化,其化学方程式为___________ 。
 和
和 ),其反应的化学方程式为
),其反应的化学方程式为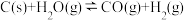 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是___________。

| A.铝粉与氧化铁的反应 |
B.氯化铵与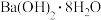 的反应 的反应 |
C.锌片与稀硫酸 反应 反应 |
| D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是
A.充入He使容器压强增大,能提高反应速率
B.
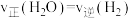 ,说明反应达到平衡状态
,说明反应达到平衡状态C.容器中焦炭的质量不再变化,说明反应达到平衡状态
D.混合气体的密度不再发生改变时,反应达平衡状态
E.升高温度,能使正反应速率增大,逆反应速率减小
(3)298K时,1gH2燃烧生成H2O(g)放热121kJ,1molH2O(l)蒸发吸热44kJ,表示H2燃烧热的热化学方程式为
(4)恒温下,将1molN2和3molH2置于体积为2L的密闭容器中进行反应N2+3H2⇌2NH3,若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为
(5)工业制备硝酸过程中,通常对氨气进行催化氧化,其化学方程式为
您最近一年使用:0次
7 . 某温度下,在1 L恒容密闭容器中3.0 mol A发生反应 ,有关数据如下:
,有关数据如下:
下列说法错误的是
 ,有关数据如下:
,有关数据如下:| 时间段/min | 产物C的平均生成速率/mol·L-1·min-1 |
| 0~2 | 0.20 |
| 0~4 | 0.15 |
| 0~6 | 0.10 |
| A.当容器内压强不再变化时,反应达到平衡状态 |
| B.2 min时,加入0.2 mol C,此时平衡逆向移动 |
| C.该温度下的平衡常数K=0.108 |
| D.5 min时,A的物质的量为2.1 mol |
您最近一年使用:0次
8 . 化学反应原理与生产、生活密切相关。
(1)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是___________(填字母)。
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图1。___________ 。
②该反应达到平衡状态的标志是___________ (填字母)。
A.Y在混合气体中的体积分数保持不变
B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变
D.生成3molY的同时生成2molZ
③4min时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(3)可以用图示法分析化学反应中的能量变化。观察图2,该反应2HI(g) I2(g)+H2(g)能量
I2(g)+H2(g)能量___________ (增加、减小)___________ kJ/mol。
(1)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是___________(填字母)。
| A.蒸馏水 | B.KNO3溶液 | C.CH3COONa固体 | D.CuSO4溶液 |
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图1。
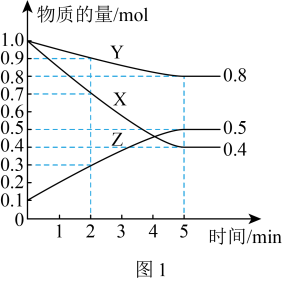
②该反应达到平衡状态的标志是
A.Y在混合气体中的体积分数保持不变
B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变
D.生成3molY的同时生成2molZ
③4min时,正反应速率
(3)可以用图示法分析化学反应中的能量变化。观察图2,该反应2HI(g)
 I2(g)+H2(g)能量
I2(g)+H2(g)能量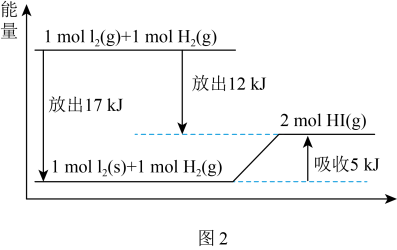
您最近一年使用:0次
9 . 完成下列问题。
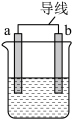
(1)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。___________ ,当电路中有0.2mol电子通过时,负极的质量减少___________ g。
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置负极材料为___________ 。
(2)当在a附近有气泡产生,b电极逐渐溶解,则___________ (a或b)作负极。
(3) (红棕色)和
(红棕色)和 (无色)之间发生反应:
(无色)之间发生反应: 。将一定量
。将一定量 气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
①该反应为吸热反应,则断裂反应物的化学键要吸收的能量___________ (填“大于”、“小于”或“等于”)形成生成物的化学键要放出的能量。
②下列可以说明该反应达到平衡的是___________ 。
A.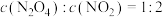 B.
B.
C.容器内气体的颜色不再变化 D.混合气体的压强不再变化
③在温度为T的条件下,向该恒容密闭容器中充入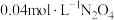 ,
, 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。 的反应速率为
的反应速率为___________ ,反应进行到16min时, 的转化率是
的转化率是___________ 。
(1)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置负极材料为
(2)当在a附近有气泡产生,b电极逐渐溶解,则
(3)
 (红棕色)和
(红棕色)和 (无色)之间发生反应:
(无色)之间发生反应: 。将一定量
。将一定量 气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
气体充入体积为2L的恒容密闭容器中,控制反应温度为T。①该反应为吸热反应,则断裂反应物的化学键要吸收的能量
②下列可以说明该反应达到平衡的是
A.
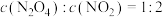 B.
B.
C.容器内气体的颜色不再变化 D.混合气体的压强不再变化
③在温度为T的条件下,向该恒容密闭容器中充入
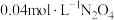 ,
, 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。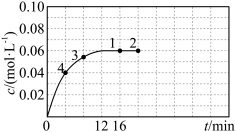
 的反应速率为
的反应速率为 的转化率是
的转化率是
您最近一年使用:0次
解题方法
10 . 定量实验是学习化学的重要途径。下列所示装置或操作能达到实验目的的是
| ① | ② | ③ | ④ |
|
|
|
|
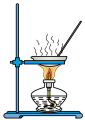
| A.图①:测定硫酸铜晶体中结晶水的含量 | B.图②:配制 NaOH溶液 NaOH溶液 |
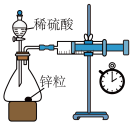
| C.图③:测量锌与稀硫酸反应的反应速率 | D.图④:中和热的测定 |
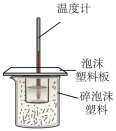
您最近一年使用:0次