19-20高三上·北京东城·期末
1 . 相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g) 2XY3(g)△H=-akJ/mol。实验测得反应的有关数据如表。下列叙述正确的是
2XY3(g)△H=-akJ/mol。实验测得反应的有关数据如表。下列叙述正确的是
 2XY3(g)△H=-akJ/mol。实验测得反应的有关数据如表。下列叙述正确的是
2XY3(g)△H=-akJ/mol。实验测得反应的有关数据如表。下列叙述正确的是| 容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间/min | 达平衡过程中的能量变化 | ||
| X2 | Y2 | XY3 | ||||
| ① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
| ② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
| A.对于上述反应,①、②中反应的平衡常数K的值不同 |
| B.①中:从开始至10min内的平均反应速率v(X2)=0.1mol/(L•min) |
| C.②中:X2的平衡转化率小于10% |
| D.b>0.1a |
您最近一年使用:0次
2021-09-15更新
|
1406次组卷
|
26卷引用:第02章 化学反应的方向、限度与速率(A卷基础强化卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)
(已下线)第02章 化学反应的方向、限度与速率(A卷基础强化卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)(已下线)本册综合检测(二)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)【区级联考】北京市东城区2019届高三第一学期期末教学统一检测化学试题【区级联考】北京市东城区2019届高三第一学期期末考试化学试题福建省厦门外国语学校2019-2020学年高二上学期期中考试化学试题北京市101中学2019-2020学年高三化学统考三山东省济宁市2020届高三一模化学试卷北京市第101中学2020届高三4月月考化学试题四川省内江市第六中学2021届高三上学期开学考试(第一次月考)化学试题江苏省扬州中学2021届高三10月月考化学试题重庆市缙云教育联盟2020-2021学年高二9月月考化学试题河北省秦皇岛市第一中学2020-2021学年高二上学期12月月考化学试题河北省衡水市第十四中学2020-2021学年高二上学期三调考试(校外)化学试题(已下线)【一飞冲天】名家原创卷1辽宁省沈阳市郊联体2020-2021学年高一下学期期末考试化学试题河北正定中学2022届高三上学期第三次月考化学试题河北正定中学2020-2021学年高三下学期开学考试化学试题江西省南昌市南昌大学附属中学 2021-2022学年高二上学期第一次月考化学试卷重庆市第七中学校2022届高三第二次月考化学试题山东省烟台市莱州第一中学2021-2022学年高二上学期10月月考化学试题河南省南阳市一中2021-2022学年高二上学期第一次月考化学试题(已下线)专题22 化学平衡 化学平衡常数 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练河北省石家庄市第二中学2021-2022学年高三上学期11月第一次考试化学试题(已下线)专项特训3 多平衡体系的综合分析河北省部分学校2023届高三4月大联考二模化学试题吉林省长春市东北师范大学附属中学2023-2024学年高二上学期10月期中化学试题
名校
解题方法
2 . Ⅰ.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下反应: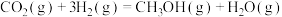 ,测得CO2和
,测得CO2和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
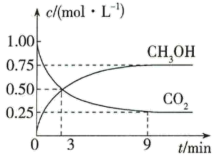
(1)从3min到9min,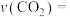
___________  (计算保留2位有效数字)。
(计算保留2位有效数字)。
(2)能说明上述反应达到平衡状态的是___________ (填字母)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1mol H2,同时生成1mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为___________ 。
(4)平衡混合气体中 和
和 的质量之比是
的质量之比是___________ 。
(5)第3分钟时
___________ 第9分钟时 (填“>”“<”“=”或“无法比较”)。
(填“>”“<”“=”或“无法比较”)。
Ⅱ.(1)在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。
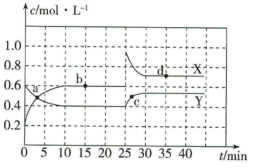
①写出该反应的化学方程式(反应物或生成物用符号X、Y表示):___________ 。
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是___________ 。
(2)如图所示是可逆反应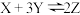 的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是___________ (填字母)。
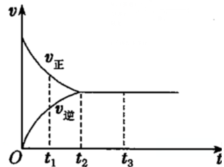
A. t1时,只有正方向反应在进行 B. t2时,反应达到最大限度
C. t2~t3,反应不再进行 D. t2~t3,各物质的浓度不再发生变化
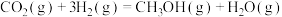 ,测得CO2和
,测得CO2和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
(1)从3min到9min,
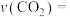
 (计算保留2位有效数字)。
(计算保留2位有效数字)。(2)能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1mol H2,同时生成1mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为
(4)平衡混合气体中
 和
和 的质量之比是
的质量之比是(5)第3分钟时

 (填“>”“<”“=”或“无法比较”)。
(填“>”“<”“=”或“无法比较”)。Ⅱ.(1)在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。

①写出该反应的化学方程式(反应物或生成物用符号X、Y表示):
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是
(2)如图所示是可逆反应
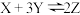 的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
A. t1时,只有正方向反应在进行 B. t2时,反应达到最大限度
C. t2~t3,反应不再进行 D. t2~t3,各物质的浓度不再发生变化
您最近一年使用:0次
2021-01-08更新
|
2592次组卷
|
3卷引用:高中化学苏教2019版必修第二册-专题6 本专题达标检测
名校
3 . 对于反应 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时 和
和 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确 的是

 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时 和
和 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法
A.实验c条件下,从反应开始至达到平衡时 |
| B.实验a条件下,用浓度表示的平衡常数为100 |
C.该反应的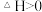 |
| D.比较实验a、c可判断升高温度反应速率加快 |
您最近一年使用:0次
2019-09-12更新
|
2566次组卷
|
12卷引用:选择性必修1 专题2 第三单元综合训练
选择性必修1 专题2 第三单元综合训练浙江省杭州市2018-2019学年高二下学前期末考试化学试题黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2020届高三上学期期中考试化学试题浙江省金华市方格外国语学校2019-2020学年高二上学期期中考试化学试题甘肃省镇原县镇原中学2019-2020学年高二上学期期中考试化学(理)试题甘肃省镇原县镇原中学2019-2020学年高一上学期期中考试化学(理)试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练江西省南昌市第三中学2020~2021学年高二上学期期中考试化学试题2.3.1浓度 压强变化对化学平衡的影响 课后重庆市长寿区八校联考2023-2024学年高二上学期1月期末化学试题
名校
解题方法
4 . 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是
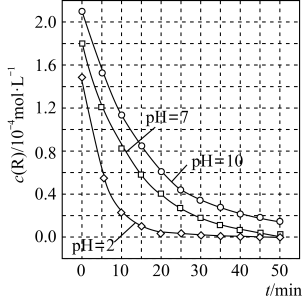

| A.在0~20min之间,pH=7时R的降解速率为0.07mol·L-1·min-1 |
| B.R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 |
| C.二氧化钛对pH=2的R溶液催化效率好 |
| D.在0~50 min之间,R的降解百分率pH=2大于pH=7 |
您最近一年使用:0次
2019-03-22更新
|
1883次组卷
|
9卷引用:第二章化学反应速率与化学平衡
第二章化学反应速率与化学平衡浙江省临海市白云高级中学2019届高三3月月考化学试题黑龙江省黑河市嫩江县高级中学2019-2020学年高二下学期第一次月考化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练(已下线)【省级联考】金丽衢十二校2018学年高三第三次联考化学试题(已下线)练习5 化学反应的方向与调控-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)广东省广大附中、铁一、广外三校2020-2021学年高一下学期期中联考化学试题河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题广东省江门市蓬江区三校2020-2021学年高一下学期期中联考化学试题
16-17高二下·安徽马鞍山·期中
名校
解题方法
5 . 在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g)  xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
 xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是| A.x=1 |
| B.B的转化率为50% |
| C.2min内A的反应速率为0.3mol·L-1·min-1 |
| D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态 |
您最近一年使用:0次
2017-11-14更新
|
2091次组卷
|
13卷引用:第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)
(已下线)第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)2016-2017学年安徽省马鞍山二中高二下学期期中(理科)考试化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题新疆兵团第二师华山中学2017-2018学年高二上学期期中考试化学试题四川省巴中市巴中中学2019-2020学年高二上学期期中考试化学试题湖南省株洲市醴陵市第四中学2019-2020学年高二上学期12月月考化学试题四川省广安市岳池县顾县中学2019—2020学年第一学期高二上学期期中测试化学(选修四)试题河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题安徽省安庆市九一六学校2020-2021学年高二下学期开学考试化学试题湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题(已下线)2.2.1 化学平衡状态——同步学习必备知识山东省枣庄市薛城区、滕州市2023-2024学年高二上学期期中考试化学试题重庆市巫溪县中学校2023-2024学年高二上学期第三次月考化学试题
6 . 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:________________________________________________________________ 。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
①由表中数据判断ΔH________ (填“>”、“=”或“<”)0。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,4 min达到平衡时测得c(CO)=0.2 mol·L-1,此时的温度为_____ ,则反应速率v(H2)=__________ 。
(3)T ℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g) CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的 ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。__________

(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式:_____________________________________________________ 。
(1)已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)| 温度/℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,4 min达到平衡时测得c(CO)=0.2 mol·L-1,此时的温度为
(3)T ℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)
 CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的 ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式:
您最近一年使用:0次
9-10高一下·河北邢台·单元测试
7 . 在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示:

(1)该反应还可用____________ 代替二氧化锰做催化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序为_____________________ 。试解释反应速率变化的原因是___________________ 。
(3)该H2O2水溶液的物质的量浓度为____________________ 。

(1)该反应还可用
(2)A、B、C各点所表示的反应速率由快到慢的顺序为
(3)该H2O2水溶液的物质的量浓度为
您最近一年使用:0次



