解题方法
1 . 已知橙红色的配离子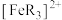 可被
可被 氧化成淡蓝色的配离子
氧化成淡蓝色的配离子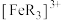 (
( 的还原产物是
的还原产物是 ),现用浓度分别为
),现用浓度分别为 、
、 、
、 的
的 溶液进行实验,
溶液进行实验,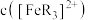 随时间
随时间 的变化曲线如图所示。下列有关说法错误的是
的变化曲线如图所示。下列有关说法错误的是
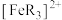 可被
可被 氧化成淡蓝色的配离子
氧化成淡蓝色的配离子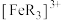 (
( 的还原产物是
的还原产物是 ),现用浓度分别为
),现用浓度分别为 、
、 、
、 的
的 溶液进行实验,
溶液进行实验,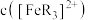 随时间
随时间 的变化曲线如图所示。下列有关说法错误的是
的变化曲线如图所示。下列有关说法错误的是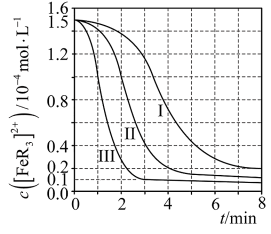
A.实验中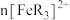 、 、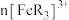 之和不变时,反应达到平衡状态 之和不变时,反应达到平衡状态 |
| B.三组实验中,反应速率都是前期速率增加,后期速率减小 |
C. 的硝酸进行实验,平衡时 的硝酸进行实验,平衡时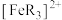 的平均消耗速率为 的平均消耗速率为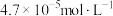 |
D.平衡后加水稀释, 增大 增大 |
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
2 . 回答下列问题
(1)某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
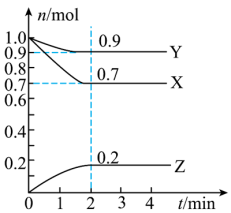
①反应从开始至2min,用Z的浓度变化表示的平均反应速率为v(Z)=___________ 。
②由图中所给数据进行分析,该反应的化学方程式为___________ 。
③下列措施能加快反应速率的有___________ 。
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.升高温度
(2)已知25℃时H3PO4的各级电离平衡常数如表所示:
①NaH2PO4水解反应的离子方程式为___________ ;其水解常数Kh=___________ (保留3位有效数字),NaH2PO4溶液呈___________ 性。(填“酸”、“碱”或“中”)
②计算H2PO +PO
+PO
 2HPO
2HPO 的平衡常数K=
的平衡常数K=___________ (保留2位有效数字)。
(1)某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。

①反应从开始至2min,用Z的浓度变化表示的平均反应速率为v(Z)=
②由图中所给数据进行分析,该反应的化学方程式为
③下列措施能加快反应速率的有
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.升高温度
(2)已知25℃时H3PO4的各级电离平衡常数如表所示:
| 平衡常数 | H3PO4 |
| Ka1 | 8×10-3 |
| Ka2 | 6×10-8 |
| Ka3 | 4×10-13 |
②计算H2PO
 +PO
+PO
 2HPO
2HPO 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
解题方法
3 . 汞及其化合物广泛应用于医药、冶金及其他精密高新科技领域。
(1)干燥的 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。该反应中氧化产物是___________ 。
(2)富氧燃烧烟气中 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为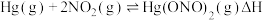
根据实验结果,有研究组提出了 与
与 的可能反应机理:
的可能反应机理:

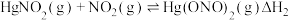

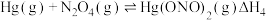
①根据盖斯定律,
___________ (写出一个代数式即可)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ 。
A.增大 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入 ,可提高原料的平衡转化率
,可提高原料的平衡转化率
D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为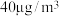 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。 的平均脱除反应速率为
的平均脱除反应速率为___________ 
ⅱ)
___________ 0(填“>”或“<”)
④富氧燃烧烟气中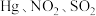 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于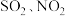 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是___________ 。 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:

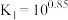
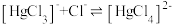
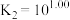
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随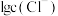 的变化如图所示
的变化如图所示 ]。
]。
①熔融状态的 不能导电,
不能导电, 是
是___________ (填“共价”或“离子”)化合物。
②A点溶液中
___________  。
。
③A点溶液中 的转化率为
的转化率为___________ (列出计算式)。
(1)干燥的
 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为(2)富氧燃烧烟气中
 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为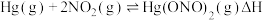
根据实验结果,有研究组提出了
 与
与 的可能反应机理:
的可能反应机理:
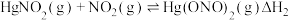

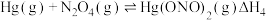
①根据盖斯定律,

②上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.增大
 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入
 ,可提高原料的平衡转化率
,可提高原料的平衡转化率D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为
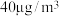 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
 的平均脱除反应速率为
的平均脱除反应速率为
ⅱ)

④富氧燃烧烟气中
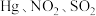 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于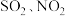 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是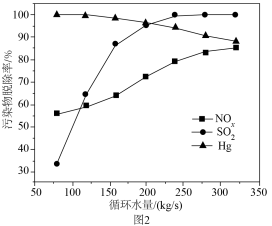
 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:
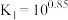
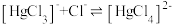
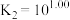
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随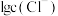 的变化如图所示
的变化如图所示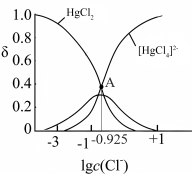
 ]。
]。①熔融状态的
 不能导电,
不能导电, 是
是②A点溶液中

 。
。③A点溶液中
 的转化率为
的转化率为
您最近一年使用:0次
名校
4 . 目前,大规模和低成本制取氢能实质上都是通过烃重整实现的,该过程主要是甲烷水蒸气重整,包括以下两步气相化学催化反应:
反应Ⅰ: CH4(g)+H2O(g) CO(g)+3H2(g) ∆H=+206 kJ·mol-1
CO(g)+3H2(g) ∆H=+206 kJ·mol-1
反应Ⅱ: CO(g)+H2O(g) CO2(g)+H2(g) ∆H=-41 kJ·mol-1
CO2(g)+H2(g) ∆H=-41 kJ·mol-1
(1)反应:CH4(g)+2H2O(g) CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= ___________
(2)将2molCO和lmolH2O充入某容积不变的绝热密闭容器中,发生反应Ⅱ,下列说法正确的是___________ 。
A.断2个O-H键同时 断2个C=O键,能判断反应Ⅱ达到平衡
B.混合气体的密度保持不变,能判断反应Ⅱ达到平衡
C.混合气体的平均相对分子质量保持不变,能判断反应Ⅱ达到平衡
D.容器内温度不再变化,能判断反应Ⅱ达到平衡
E.反应Ⅱ平衡后,充入氮气,压强增大,平衡不移动
(3)甲烷水蒸气重整得到的CO2与H2,可以催化重整制备CH3OCH3,制备的过程中存在反应:
①2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H<0;
CH3OCH3(g)+3H2O(g) ∆H<0;
②CO2(g)+H2(g) CO(g)+H2O(g) ∆H>0。
CO(g)+H2O(g) ∆H>0。
向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示,P1、P2、 P3由大到小的顺序为___________ ;T2°C时主要发生反应___________ 。(填“①”或“②”),CO2平衡转化率随温度变化先降后升的原因为___________ 。
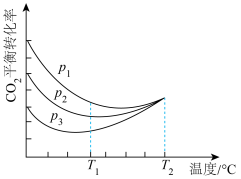
(4)甲烷水蒸气重整得到的CO2和H2, 也可用来制备甲醇,反应方程式CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
①用CO2表示前2h的平均反应速率v(CO2)=___________ mol/(L·h)。
②该条件下的分压平衡常数为Kp=___________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
反应Ⅰ: CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H=+206 kJ·mol-1
CO(g)+3H2(g) ∆H=+206 kJ·mol-1反应Ⅱ: CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H=-41 kJ·mol-1
CO2(g)+H2(g) ∆H=-41 kJ·mol-1(1)反应:CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= (2)将2molCO和lmolH2O充入某容积不变的绝热密闭容器中,发生反应Ⅱ,下列说法正确的是
A.断2个O-H键同时 断2个C=O键,能判断反应Ⅱ达到平衡
B.混合气体的密度保持不变,能判断反应Ⅱ达到平衡
C.混合气体的平均相对分子质量保持不变,能判断反应Ⅱ达到平衡
D.容器内温度不再变化,能判断反应Ⅱ达到平衡
E.反应Ⅱ平衡后,充入氮气,压强增大,平衡不移动
(3)甲烷水蒸气重整得到的CO2与H2,可以催化重整制备CH3OCH3,制备的过程中存在反应:
①2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ∆H<0;
CH3OCH3(g)+3H2O(g) ∆H<0;②CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H>0。
CO(g)+H2O(g) ∆H>0。向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示,P1、P2、 P3由大到小的顺序为

(4)甲烷水蒸气重整得到的CO2和H2, 也可用来制备甲醇,反应方程式CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
②该条件下的分压平衡常数为Kp=
您最近一年使用:0次
名校
解题方法
5 . 一定温度下,在体积为1L的恒容密闭容器中加入1mol CO和1mol NO发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是
N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是

 N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是
N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是
| A.当混合气体的平均摩尔质量不再改变时,该反应达到平衡状态 |
| B.曲线b表示物质的φ-t关系中,正反应速率v(t3)>v(t4) |
| C.曲线b表示的是N2的φ~t关系 |
D.若起始压强为P0,则该反应温度下Kp= (分压=物质的量分数×总压,用含P0的式子表示) (分压=物质的量分数×总压,用含P0的式子表示) |
您最近一年使用:0次
2024-02-27更新
|
301次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高二上学期期末考试化学试题
名校
解题方法
6 . 利用甲醇 催化脱氢法制备甲酸甲酯
催化脱氢法制备甲酸甲酯 涉及到如下化学反应:
涉及到如下化学反应:
反应Ⅰ: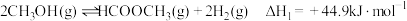
反应Ⅱ: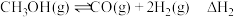
反应Ⅲ:
回答下列问题:
(1)
___________  。
。
(2) ,向密闭容器中通入
,向密闭容器中通入 ,恒压条件下进行反应Ⅰ。
,恒压条件下进行反应Ⅰ。
①下列有关说法正确是___________ (填标号)。
A.高温有利于反应Ⅰ自发
B. 说明该反应体系达到平衡状态
说明该反应体系达到平衡状态
C.温度升高有利于提高 的转化率
的转化率
D.通过减小 分压可以提高
分压可以提高 的平衡产率
的平衡产率
②要缩短达到平衡的时间,可采取的措施有___________ 。
③ ,测得体系中反应Ⅰ的平衡转化率和进料时甲醇的分压
,测得体系中反应Ⅰ的平衡转化率和进料时甲醇的分压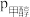 (分压=总压×物质的量分数)关系如图.M点
(分压=总压×物质的量分数)关系如图.M点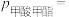
___________  ;该反应的平衡常数
;该反应的平衡常数
___________  (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。 上高度分散的铜颗粒催化剂
上高度分散的铜颗粒催化剂 制备方法如下.
制备方法如下.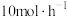 的流速通过负载
的流速通过负载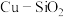 的催化反应器,甲醇转化率和甲酸甲酯选择性随
的催化反应器,甲醇转化率和甲酸甲酯选择性随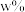 、反应温度的变化如图.
、反应温度的变化如图. 时,生成甲酸甲酯的反应速率为
时,生成甲酸甲酯的反应速率为___________ 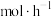 。
。
②最适合的反应温度为___________ (填标号)。
A.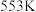 B.
B. C.
C. D.
D.
③图2中当温度高于 时,甲酸甲酯选择性下降的可能原因为
时,甲酸甲酯选择性下降的可能原因为___________ 。
 催化脱氢法制备甲酸甲酯
催化脱氢法制备甲酸甲酯 涉及到如下化学反应:
涉及到如下化学反应:反应Ⅰ:
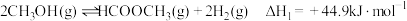
反应Ⅱ:
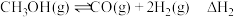
反应Ⅲ:

回答下列问题:
(1)

 。
。(2)
 ,向密闭容器中通入
,向密闭容器中通入 ,恒压条件下进行反应Ⅰ。
,恒压条件下进行反应Ⅰ。①下列有关说法正确是
A.高温有利于反应Ⅰ自发
B.
 说明该反应体系达到平衡状态
说明该反应体系达到平衡状态C.温度升高有利于提高
 的转化率
的转化率D.通过减小
 分压可以提高
分压可以提高 的平衡产率
的平衡产率②要缩短达到平衡的时间,可采取的措施有
③
 ,测得体系中反应Ⅰ的平衡转化率和进料时甲醇的分压
,测得体系中反应Ⅰ的平衡转化率和进料时甲醇的分压 (分压=总压×物质的量分数)关系如图.M点
(分压=总压×物质的量分数)关系如图.M点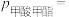
 ;该反应的平衡常数
;该反应的平衡常数
 (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
 上高度分散的铜颗粒催化剂
上高度分散的铜颗粒催化剂 制备方法如下.
制备方法如下.
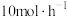 的流速通过负载
的流速通过负载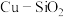 的催化反应器,甲醇转化率和甲酸甲酯选择性随
的催化反应器,甲醇转化率和甲酸甲酯选择性随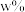 、反应温度的变化如图.
、反应温度的变化如图.
 时,生成甲酸甲酯的反应速率为
时,生成甲酸甲酯的反应速率为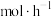 。
。②最适合的反应温度为
A.
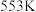 B.
B. C.
C. D.
D.
③图2中当温度高于
 时,甲酸甲酯选择性下降的可能原因为
时,甲酸甲酯选择性下降的可能原因为
您最近一年使用:0次
2024-02-27更新
|
136次组卷
|
3卷引用:福建省龙岩市2023-2024学年高三上学期期末考试化学试题
名校
解题方法
7 . 烟道气中的 本身对于
本身对于 是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。
是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。 还原
还原 的反应有:
的反应有:
i.

ii.
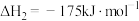
iii.

(1)已知:在标准压强、 时,由最稳定的单质合成
时,由最稳定的单质合成 物质
物质 的反应焓变,叫做物质
的反应焓变,叫做物质 的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
_______ ,
_______ 。

(2)将 与
与 按物质的量之比为
按物质的量之比为 进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下,
进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下, 的转化率及生成硫的选择性[硫的选择性
的转化率及生成硫的选择性[硫的选择性 ]随反应温度变化的结果如下表所示:
]随反应温度变化的结果如下表所示:
①当以 作催化剂时,试分析
作催化剂时,试分析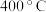 时反应是否达到平衡状态,并说明理由
时反应是否达到平衡状态,并说明理由________ ;请解释 转化率随温度变化的可能原因是
转化率随温度变化的可能原因是________ 。
②根据以上数据判断, 与
与 反应得到硫磺的最合适条件是
反应得到硫磺的最合适条件是________ 。
(3)在一定温度和某催化剂的条件下,将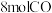 和
和 混合气体置于
混合气体置于 刚性密闭容器中进行上述反应,
刚性密闭容器中进行上述反应, 时反应达到平衡状态,测得
时反应达到平衡状态,测得 的转化率为
的转化率为 ,得到
,得到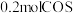 ,计算
,计算 内用
内用 表示的平均反应速率为
表示的平均反应速率为________ ;硫的选择性
_______ ;反应 的平衡常数
的平衡常数
______ (列出计算式,不用化简)。
 本身对于
本身对于 是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。
是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。 还原
还原 的反应有:
的反应有:i.


ii.

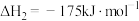
iii.


(1)已知:在标准压强、
 时,由最稳定的单质合成
时,由最稳定的单质合成 物质
物质 的反应焓变,叫做物质
的反应焓变,叫做物质 的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:


(2)将
 与
与 按物质的量之比为
按物质的量之比为 进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下,
进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下, 的转化率及生成硫的选择性[硫的选择性
的转化率及生成硫的选择性[硫的选择性 ]随反应温度变化的结果如下表所示:
]随反应温度变化的结果如下表所示:温度( ) ) |  |  |  |  | ||||
| 转化率 | 选择性 | 转化率 | 选择性 | 转化率 | 选择性 | 转化率 | 选择性 | |
| 300 | 0.30 | 0.33 | 0.05 | 0.84 | 0.24 | 0.48 | 0.11 | 0.48 |
| 350 | 0.32 | 0.55 | 0.11 | 0.90 | 0.34 | 0.70 | 0.12 | 0.48 |
| 400 | 0.30 | 0.68 | 0.25 | 0.95 | 0.45 | 0.87 | 0.14 | 0.50 |
| 450 | 0.29 | 0.72 | 0.40 | 0.95 | 0.49 | 0.98 | 0.15 | 0.50 |
| 500 | 0.28 | 0.85 | 0.48 | 0.95 | 0.50 | 1.00 | 0.17 | 0.51 |
 作催化剂时,试分析
作催化剂时,试分析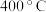 时反应是否达到平衡状态,并说明理由
时反应是否达到平衡状态,并说明理由 转化率随温度变化的可能原因是
转化率随温度变化的可能原因是②根据以上数据判断,
 与
与 反应得到硫磺的最合适条件是
反应得到硫磺的最合适条件是(3)在一定温度和某催化剂的条件下,将
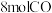 和
和 混合气体置于
混合气体置于 刚性密闭容器中进行上述反应,
刚性密闭容器中进行上述反应, 时反应达到平衡状态,测得
时反应达到平衡状态,测得 的转化率为
的转化率为 ,得到
,得到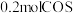 ,计算
,计算 内用
内用 表示的平均反应速率为
表示的平均反应速率为
 的平衡常数
的平衡常数
您最近一年使用:0次
2024-02-26更新
|
104次组卷
|
3卷引用:河北省2023-2024学年高三上学期质量监测期末联考化学试题
解题方法
8 . 将2 mol N2和6 mol H2通入2 L密闭容器中,分别在T1和T2温度下进行反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。下图曲线分别表示X的浓度(或Y的物质的量)随时间的变化(X、Y分别代表某一种反应物或生成物)。下列说法正确的是
2NH3(g) ΔH<0。下图曲线分别表示X的浓度(或Y的物质的量)随时间的变化(X、Y分别代表某一种反应物或生成物)。下列说法正确的是

 2NH3(g) ΔH<0。下图曲线分别表示X的浓度(或Y的物质的量)随时间的变化(X、Y分别代表某一种反应物或生成物)。下列说法正确的是
2NH3(g) ΔH<0。下图曲线分别表示X的浓度(或Y的物质的量)随时间的变化(X、Y分别代表某一种反应物或生成物)。下列说法正确的是
| A.X表示的物质是H2 |
B.T2温度下,该反应的平衡常数为 |
| C.T2温度下,4~12 min的反应速率v(H2)=0.05 mol∙L–1∙min–1 |
| D.T2温度下,反应达到平衡时容器内气体的压强较大 |
您最近一年使用:0次
名校
解题方法
9 . 尿素是一种很好用的保湿成分,它存在于肌肤的角质层当中,属于肌肤天然保湿因子NMF的主要成分。工业上以氨气和二氧化碳为原料合成尿素,反应分为如下两步:
反应①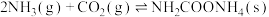
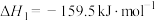
反应②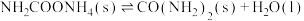

(1)下列反应与反应②的热效应相同的是___________。
(2)下图能表示上述两步反应能量变化的是___________。
(3)恒温恒容时,将2mol 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率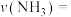
___________ (写出计算过程)。
(4)若将2mol 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
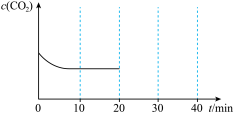
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内 随时间t变化的曲线
随时间t变化的曲线___________ 。
(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:___________ 。
反应①
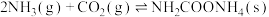
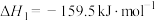
反应②
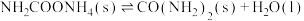

(1)下列反应与反应②的热效应相同的是___________。
| A.木炭与高温水蒸气反应 | B.镁条与稀盐酸反应 |
| C.小苏打与柠檬酸钠反应 | D.氢气与氯气反应 |
(2)下图能表示上述两步反应能量变化的是___________。
A.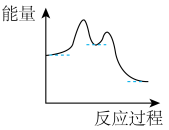 | B.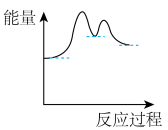 | C. | D.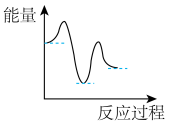 |
(3)恒温恒容时,将2mol
 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率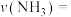
(4)若将2mol
 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内
 随时间t变化的曲线
随时间t变化的曲线(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:
您最近一年使用:0次
解题方法
10 . 双氧水在工业、医药等领域应用广泛。某小组采用如下方法制备 并探究
并探究 的分解反应机理。回答下列问题:
的分解反应机理。回答下列问题:
Ⅰ.电解-水解法制备 制备步骤:
制备步骤:
(1)①电解硫酸氢钾饱和溶液,制取 ;
;
②将电解所得 酸化水解制取
酸化水解制取 。电解时阳极反应式为
。电解时阳极反应式为___________ 。

Ⅱ.探究的分解反应机理
①按图1连接装置,检查装置气密性;
②向a中加入60mL15%H2O2,观察现象,通过pH传感器测pH;
③20s时,打开双通阀,向a中加入1滴管 溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。

回答下列问题:
(2)仪器a的名称是___________ ,已知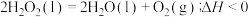 ,据此分析并说明常温常压下
,据此分析并说明常温常压下 能否分解
能否分解___________ ,前20s测得溶液pH为3.47,其原因是___________ (用电离方程式表示)。
(3)步骤③中加入 溶液后的现象为
溶液后的现象为___________ 、溶液颜色由黄色变深,又变回黄色。20~23s pH变化的原因是___________ 。结合图2和图3,23~150s pH变化对应的历程为___________ (用序号表示),150s后pH变化的原因是___________ (用反应式表示)。
(4)加入 溶液后,150s时收集到19.5mL
溶液后,150s时收集到19.5mL ,则用
,则用 的体积变化表示该反应的速率为
的体积变化表示该反应的速率为___________ 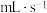 。该实验证明催化剂通过改变反应历程,从而加快反应速率。
。该实验证明催化剂通过改变反应历程,从而加快反应速率。
 并探究
并探究 的分解反应机理。回答下列问题:
的分解反应机理。回答下列问题:Ⅰ.电解-水解法制备
 制备步骤:
制备步骤:(1)①电解硫酸氢钾饱和溶液,制取
 ;
;②将电解所得
 酸化水解制取
酸化水解制取 。电解时阳极反应式为
。电解时阳极反应式为
Ⅱ.探究的分解反应机理
①按图1连接装置,检查装置气密性;
②向a中加入60mL15%H2O2,观察现象,通过pH传感器测pH;
③20s时,打开双通阀,向a中加入1滴管
 溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
回答下列问题:
(2)仪器a的名称是
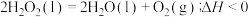 ,据此分析并说明常温常压下
,据此分析并说明常温常压下 能否分解
能否分解(3)步骤③中加入
 溶液后的现象为
溶液后的现象为(4)加入
 溶液后,150s时收集到19.5mL
溶液后,150s时收集到19.5mL ,则用
,则用 的体积变化表示该反应的速率为
的体积变化表示该反应的速率为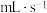 。该实验证明催化剂通过改变反应历程,从而加快反应速率。
。该实验证明催化剂通过改变反应历程,从而加快反应速率。
您最近一年使用:0次



