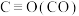1 . 室温下,将 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: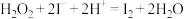 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。
回答下列问题:
(1)反应B的离子方程式是______ 。 的作用为
的作用为______ 。
(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
①实验Ⅰ中,若2s时 的浓度变为
的浓度变为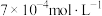 ,则0~2s时
,则0~2s时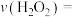
______ 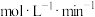
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则
______ ;实验Ⅲ和实验Ⅳ对照实验的目的为______ ;若探究温度对溶液颜色第一次变蓝快慢的影响因素,可选择实验______ 和实验______ (填写“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: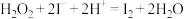 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。回答下列问题:
(1)反应B的离子方程式是
 的作用为
的作用为(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
试剂用量(mL) 序号 | 温度 | 0.01 | 0.01 | 0.01 | 0.01 |
|
Ⅰ | 25℃ | 5 | 4 | 8 | 3 | 0 |
Ⅱ | 25℃ | 5 | 2 | x | y | z |
Ⅲ | 35℃ | 5 | 4 | 8 | 3 | 0 |
Ⅳ | 35℃ | 3 | 4 | 8 | 3 | 2 |
 的浓度变为
的浓度变为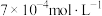 ,则0~2s时
,则0~2s时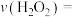
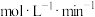
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则

您最近一年使用:0次
名校
2 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨CO2。该甲醇的制备反应及副反应如下:
ⅰ. (放热反应)
(放热反应)
ⅱ. (吸热反应)
(吸热反应)
(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
若CO2与足量H2发生反应转化为1molCO和水蒸气时吸收热量为42kJ,则
______ 。
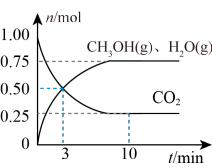
(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:______ 。
②下列措施一定可以提高甲醇生成速率的是______ 。
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是______ 。
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
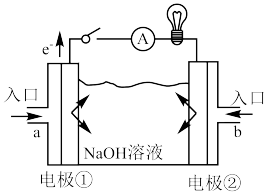
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。______ 极,B极的电极反应式为____________ 。
ⅰ.
 (放热反应)
(放热反应)ⅱ.
 (吸热反应)
(吸热反应)(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
化学键 | H-O | C=O(CO2) | H-H |
|
键能/ | 462.8 | 803.0 | 436.0 | x |

(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
②下列措施一定可以提高甲醇生成速率的是
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

您最近一年使用:0次
名校
3 . Ⅰ.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为两种无毒气体。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。___________ 逆反应速率(填“>”“<”或“=”)。
(2)该反应的化学方程式为___________ 。
(3)从反应开始到达到平衡,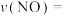
___________  ;该条件下,设起始压强为P,平衡时压强为
;该条件下,设起始压强为P,平衡时压强为 ,则
,则 的值为
的值为___________ 。
(4) 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为___________ 。 ,反应过程中的能量变化如图所示。
,反应过程中的能量变化如图所示。___________ (填“放热”或“吸热”)反应,生成1mol  吸收或放出的热量为
吸收或放出的热量为___________ kJ(用a,b表示)。
(6)在恒容条件下进行该反应,下列叙述能说明反应达到平衡状态的是___________ (请用相应字母填空);
a.CO和 的浓度保持不变
的浓度保持不变
b.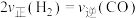
c.每生成1mol 的同时有2mol H-H键形成
的同时有2mol H-H键形成
d.容器内气体密度保持不变
e.容器内质量保持不变

(2)该反应的化学方程式为
(3)从反应开始到达到平衡,
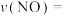
 ;该条件下,设起始压强为P,平衡时压强为
;该条件下,设起始压强为P,平衡时压强为 ,则
,则 的值为
的值为(4)
 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为
 ,反应过程中的能量变化如图所示。
,反应过程中的能量变化如图所示。
 吸收或放出的热量为
吸收或放出的热量为(6)在恒容条件下进行该反应,下列叙述能说明反应达到平衡状态的是
a.CO和
 的浓度保持不变
的浓度保持不变b.

c.每生成1mol
 的同时有2mol H-H键形成
的同时有2mol H-H键形成d.容器内气体密度保持不变
e.容器内质量保持不变
您最近一年使用:0次
名校
4 . 2020年9月22日,国家主席习近平在第75届联合国大会上宣布:中国二氧化碳排放力争2030年前达到峰值,2060年前实现“碳中和”。为达成这一目标,要尽量减少不可避免的碳排放。
(1)工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为 ,该反应的能量变化图像如图所示。
,该反应的能量变化图像如图所示。_______ 。
A.铝粉与氧化铁的反应
B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应
D.钠与冷水的反应
②一定温度下,在2L的恒容密闭容器中,加入0.02molC(s)和0.01mol 发生反应:
发生反应: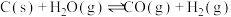 ,充分反应5min时,测得容器中CO的物质的量有0.008mol。以
,充分反应5min时,测得容器中CO的物质的量有0.008mol。以 表示的化学反应速率
表示的化学反应速率 为
为_______ 。
③我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
 反应放热。在低温下获得高产率。反应过程示意图如下图:
反应放热。在低温下获得高产率。反应过程示意图如下图:_______ 。
A.据图可知起始时的2个 分子最终都参与了反应
分子最终都参与了反应
B.过程Ⅰ、过程Ⅱ均为吸热过程,
C.过程Ⅲ只生成了极性共价键
D.使用催化剂缩小反应物和生成物的能量差
(2)以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示: 完全分解生成CO(g)和
完全分解生成CO(g)和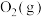 需要
需要_______ (填“吸收”或“放出”)_______ kJ的能量。
(3) 分解产生的CO和
分解产生的CO和 可以作为
可以作为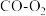 燃料电池的原料。下图为
燃料电池的原料。下图为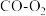 燃料电池的构造示意图,根据电子运动方向,可知氧气从
燃料电池的构造示意图,根据电子运动方向,可知氧气从_______ 口通入(填“a”或“b”);X极为电池的_______ (填“正”或“负”)极,电极反应为_______ , 向
向_______ 极移动(填“X”或“Y”);若两极共消耗气体3.36L(标准状况下),则通过导线的电子数为_______ 。
(1)工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和
 ),其反应的化学方程式为
),其反应的化学方程式为 ,该反应的能量变化图像如图所示。
,该反应的能量变化图像如图所示。
A.铝粉与氧化铁的反应
B.氯化铵与
 的反应
的反应C.锌片与稀硫酸的反应
D.钠与冷水的反应
②一定温度下,在2L的恒容密闭容器中,加入0.02molC(s)和0.01mol
 发生反应:
发生反应: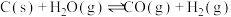 ,充分反应5min时,测得容器中CO的物质的量有0.008mol。以
,充分反应5min时,测得容器中CO的物质的量有0.008mol。以 表示的化学反应速率
表示的化学反应速率 为
为③我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
 反应放热。在低温下获得高产率。反应过程示意图如下图:
反应放热。在低温下获得高产率。反应过程示意图如下图:
A.据图可知起始时的2个
 分子最终都参与了反应
分子最终都参与了反应B.过程Ⅰ、过程Ⅱ均为吸热过程,
C.过程Ⅲ只生成了极性共价键
D.使用催化剂缩小反应物和生成物的能量差
(2)以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
 完全分解生成CO(g)和
完全分解生成CO(g)和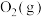 需要
需要(3)
 分解产生的CO和
分解产生的CO和 可以作为
可以作为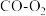 燃料电池的原料。下图为
燃料电池的原料。下图为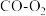 燃料电池的构造示意图,根据电子运动方向,可知氧气从
燃料电池的构造示意图,根据电子运动方向,可知氧气从 向
向
您最近一年使用:0次
名校
5 . 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:___________ ,Y的转化率为___________ 。
(2)该反应的化学方程式为___________ 。
(3)下列能表示该反应达平衡状态的是___________(填选项字母)。
(4)10s后保持其他条件不变,判断改变下列条件后反应速率的变化情况:
A.继续通入一定量的X:___________ (填“增大”、“减小”或“不变”,下同)。
B.继续通入一定量的He:___________ 。
(5)下列图像或实验属于放热反应的是___________ (填序号)。___________ (填物质名称),负极的电极反应式为___________ 。

(2)该反应的化学方程式为
(3)下列能表示该反应达平衡状态的是___________(填选项字母)。
| A.容器内气体质量不再发生变化 |
| B.容器内气体压强不再发生变化 |
| C.X的体积分数不再改变 |
| D.容器内混合气体的密度不再发生变化 |
(4)10s后保持其他条件不变,判断改变下列条件后反应速率的变化情况:
A.继续通入一定量的X:
B.继续通入一定量的He:
(5)下列图像或实验属于放热反应的是

您最近一年使用:0次
名校
解题方法
6 . 甲烷是重要的燃料和化工原料,一种利用CO2制备CH4的反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:___________ ;5~10min内,用H2O(g)表示的平均反应速率v(H2O)=___________ mol/(L·min);下列措施能加快上述反应的正反应速率的是___________ (填标号)。
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是___________ (填标号);反应达到平衡时,H2的转化率为___________ ,平衡时的压强与初始压强的比值为___________ (填最简整数比)。
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗___________ L(换算成标准状况下)H2,生成___________ gCH4。
 CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题: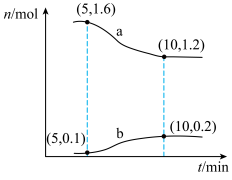
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗
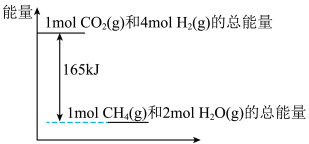
您最近一年使用:0次
名校
7 . T℃时,某化学兴趣小组将1.0mL0.015mol/LKMnO4和1.5mol/LH2SO4的混合溶液与1.0mL0.15mol/L乙醛(CH3CHO)溶液混合后,得到c( )随时间变化的关系如图,已知反应原理为
)随时间变化的关系如图,已知反应原理为 +CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
+CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
 )随时间变化的关系如图,已知反应原理为
)随时间变化的关系如图,已知反应原理为 +CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
+CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
| A.可用浓盐酸和KMnO4配制成酸性KMnO4溶液 |
B.30.0~50.0s内, 的平均速率为0.54mol/(L·h) 的平均速率为0.54mol/(L·h) |
| C.0~30s的平均反应速率大于30~50s的原因是0~30s内生成物的浓度更小 |
D.该实验中反应的离子方程式为2 +5CH3CHO+6H+=2Mn2++5CH3COOH+3H2O +5CH3CHO+6H+=2Mn2++5CH3COOH+3H2O |
您最近一年使用:0次
8 . 常温下,往烧杯中加入10mL1mol/LFeCl3溶液和10mL2mol/LKI溶液,c(I-)随时间变化如图所示,不考虑溶液混合时体积的改变。下列说法正确的是
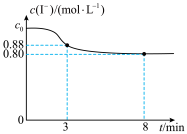
| A.c0=2 |
| B.3~8min内,Fe3+的平均反应速率为0.08mol/(L·min) |
| C.8min时,往烧杯中滴加KSCN溶液,溶液不变红 |
D.烧杯中发生反应的离子方程式为2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
您最近一年使用:0次
名校
9 . 化学反应过程既有物质变化也有能量变化。
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。
(1)由 和
和 合成氨时,需要
合成氨时,需要_____________ (填“吸收”或“放出”)能量,写出该反应的热化学方程式_________________ 。
Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。_______ (填“氧化反应”或“还原反应”),电池工作过程中, 向极移动
向极移动_________ (填“A”或“B”);
②该燃料电池的总反应方程式可表示为__________ 。在标准状况下,若A极区产生11.2L  ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是__________ mol。
Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:_____________ 。
(4)反应开始至2min,以气体X表示的平均反应速率为___________ 。
(5)下列措施能增大反应速率的是_________ 。
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436
 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。(1)由
 和
和 合成氨时,需要
合成氨时,需要Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。
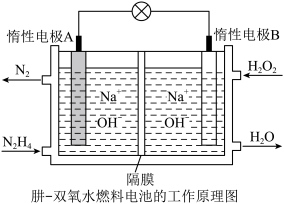
 向极移动
向极移动②该燃料电池的总反应方程式可表示为
 ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
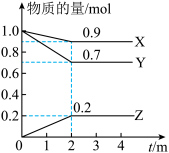
(4)反应开始至2min,以气体X表示的平均反应速率为
(5)下列措施能增大反应速率的是
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
| A.混合气体的压强不随时间的变化而变化 | B. |
| C.X体积分数保持不变 | D.混合气体的密度不随时间的变化而变化 |
您最近一年使用:0次
10 . 相同条件下,在固定容积的密闭容器中选用不同的催化剂(a、b、c)发生反应:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
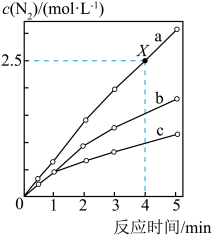
 5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
5N2(g)+6H2O(g),反应产生N2的物质的量浓度随时间变化如图所示。下列说法错误的是
| A.催化剂的催化效率:a>b>c |
| B.X点时,NH3的化学反应速率为0.5 mol·L-1·min-1 |
| C.使用催化剂a、b、c达到平衡时NO的转化率相等 |
| D.若在恒容绝热的密闭容器中发生该反应,当K值不变时,说明反应已经达到平衡 |
您最近一年使用:0次