山东省潍坊市2023-2024学年高一下学期期中考试化学试题
山东
高一
期中
2024-05-22
248次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础、化学与STSE
山东省潍坊市2023-2024学年高一下学期期中考试化学试题
山东
高一
期中
2024-05-22
248次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础、化学与STSE
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 核废水排海对全球海洋安全造成严重威胁,核废水中含有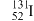 、
、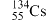 、
、 、
、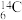 、
、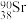 等放射性物质。下列叙述正确的是
等放射性物质。下列叙述正确的是
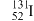 、
、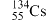 、
、 、
、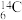 、
、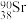 等放射性物质。下列叙述正确的是
等放射性物质。下列叙述正确的是A.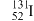 原子所含中子数与质子数之差为78 原子所含中子数与质子数之差为78 | B.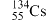 和 和 互称为同素异形体 互称为同素异形体 |
C.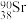 的核外电子数为52 的核外电子数为52 | D.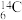 和 和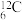 的中子数之差为2 的中子数之差为2 |
您最近一年使用:0次
单选题
|
较易(0.85)
2. 下列化学用语正确的是
A. 的电子式: 的电子式: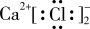 |
B.用原子表示离子键的形成过程: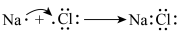 |
C.次氯酸分子的结构式: |
D.熔融 电离: 电离: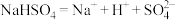 |
您最近一年使用:0次
2024-05-28更新
|
202次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
较易(0.85)
3. 下列反应中产物总能量大于反应物总能量的是
| A.铝片和稀盐酸反应 | B.甲烷在氧气中的燃烧 |
| C.硫酸与KOH溶液反应 | D.碳酸氢钠与柠檬酸反应 |
【知识点】 化学反应中能量变化的原因 吸热反应和放热反应解读
您最近一年使用:0次
2024-05-28更新
|
157次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
较易(0.85)
4. 下列实验装置能达到实验目的的是
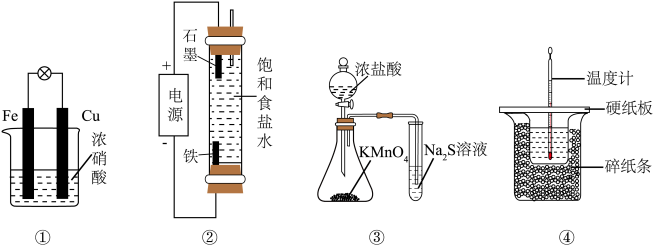
| A.装置①验证Fe和Cu的还原性强弱 | B.装置②制备少量NaClO |
C.装置③比较 、 、 和S的氧化性 和S的氧化性 | D.装置④测定中和反应的反应热 |
您最近一年使用:0次
2024-05-28更新
|
125次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
5. “中国天眼”探测到距离地球79光年的恒星光谱,经分析该恒星的组成元素有硅、磷、硫、铁等。下列有关说法正确的是
| A.原子半径大小:Si<P<S |
| B.高纯硅常用于制造光导纤维 |
C.根据元素周期律判断酸性: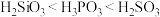 |
D.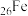 位于第4周期第Ⅷ族 位于第4周期第Ⅷ族 |
您最近一年使用:0次
2024-05-28更新
|
97次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
6. 电化学在生产、生活中有广泛的应用。下列说法正确的是
| A.铁腐蚀消耗氧气和水,食品包装袋的双吸剂可用铁粉为主要成分制作 |
B.航天器所用的氢氧燃料电池中,通入 的电极为电池的负极 的电极为电池的负极 |
C.铁钉镀铜使用硫酸铜溶液做电镀液、铜做阴极、铁做阳极,能维持电镀液 浓度不变 浓度不变 |
| D.铜的电解精炼时,粗铜中含有的锌、金、银等金属在阳极沉降下来形成阳极泥 |
您最近一年使用:0次
2024-05-28更新
|
102次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
7.  在1100℃还原
在1100℃还原 可得到高纯硅,实验室用下列装置模拟该过程(部分夹持和加热装置省略)。已知:
可得到高纯硅,实验室用下列装置模拟该过程(部分夹持和加热装置省略)。已知: 沸点33℃,遇水剧烈反应生成硅酸。下列说法正确的是
沸点33℃,遇水剧烈反应生成硅酸。下列说法正确的是
 在1100℃还原
在1100℃还原 可得到高纯硅,实验室用下列装置模拟该过程(部分夹持和加热装置省略)。已知:
可得到高纯硅,实验室用下列装置模拟该过程(部分夹持和加热装置省略)。已知: 沸点33℃,遇水剧烈反应生成硅酸。下列说法正确的是
沸点33℃,遇水剧烈反应生成硅酸。下列说法正确的是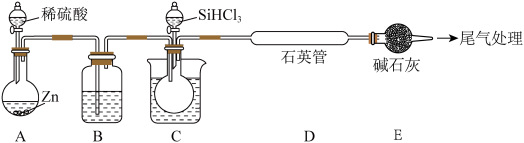
| A.装置B中试剂为饱和食盐水 |
| B.装置C应采取冰水浴 |
| C.装置E的作用是吸收HCl并防止空气中水蒸气进入 |
| D.反应结束后应先关闭装置A活塞,再停止加热D |
【知识点】 化学实验方案的设计与评价 物质制备的探究解读
您最近一年使用:0次
2024-05-28更新
|
175次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
名校
8. 海带灼烧、溶解、过滤后得到含 的溶液.再经以下步骤得到碘单质:
的溶液.再经以下步骤得到碘单质:
 的溶液.再经以下步骤得到碘单质:
的溶液.再经以下步骤得到碘单质: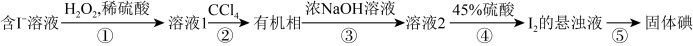
| A.由溶液1到碘的悬浊液的过程实现了碘的富集 |
| B.步骤②和步骤③所用的操作方法相同 |
| C.上述过程中发生的氧化还原反应有2个 |
| D.分液时先打开分液漏斗上口玻璃塞,再打开下端活塞 |
您最近一年使用:0次
2024-05-29更新
|
351次组卷
|
3卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
9. 下列各选项中,微粒按氧化性由弱到强、原子或离子半径由大到小的顺序排列的是
| A.O、Cl、S、P | B. 、 、 、 、 、 、 |
| C.Li、Na、K、Rb | D. 、 、 、 、 、 、 |
您最近一年使用:0次
2024-05-28更新
|
103次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
10. 深埋在土壤中的铁管道,在硫酸盐还原菌(SRB)作用下,能发生厌氧电化学腐蚀,溶液中的 完全转化为FeS,其电化学腐蚀原理如图所示。下列说法错误的是
完全转化为FeS,其电化学腐蚀原理如图所示。下列说法错误的是
 完全转化为FeS,其电化学腐蚀原理如图所示。下列说法错误的是
完全转化为FeS,其电化学腐蚀原理如图所示。下列说法错误的是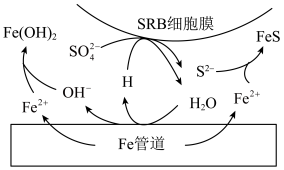
A.Fe发生腐蚀时的正极反应式: |
B.Fe腐蚀后生成 和FeS的物质的量之比为2∶1 和FeS的物质的量之比为2∶1 |
| C.铁管道与电源负极相连,可使其表面的腐蚀电流接近于零 |
| D.潮湿的土壤中比干燥土壤中发生厌氧腐蚀的速度快 |
【知识点】 金属的电化学腐蚀与防护 金属的化学腐蚀与电化学腐蚀解读
您最近一年使用:0次
2024-05-28更新
|
106次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
11. 根据实验操作和现象,对应结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 固体粉末加入过量NaOH溶液,搅拌 固体粉末加入过量NaOH溶液,搅拌 | 固体完全溶解,形成无色溶液 |  既体现酸性又体现碱性 既体现酸性又体现碱性 |
B | 用洁净的铂丝蘸取某溶液在酒精灯火焰灼烧 | 火焰呈黄色 | 该溶液是钠的盐溶液 |
C | 将银和硝酸银溶液与铜和硫酸铜稀溶液组成原电池,连通后一段时间 | 银表面有金属沉积,铜附近溶液蓝色变深 | 铜的金属性比银强 |
D | 向两支均盛有5mL 10%  溶液的试管中,分别加入0.1 溶液的试管中,分别加入0.1 的 的 溶液和0.1 溶液和0.1  溶液 溶液 | 产生气泡,加入 溶液的试管中产生气泡快 溶液的试管中产生气泡快 |  比 比 的催化效果更好 的催化效果更好 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-28更新
|
174次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
解题方法
12. X、Y、Z、W是原子序数依次增大的四种短周期元素,最外层电子数之和为17。Y是地壳中含量最多的元素,X、Y形成的某种化合物可表示为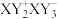 ,Z最外层电子数与K层电子数相等。下列说法错误的是
,Z最外层电子数与K层电子数相等。下列说法错误的是
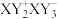 ,Z最外层电子数与K层电子数相等。下列说法错误的是
,Z最外层电子数与K层电子数相等。下列说法错误的是| A.简单离子半径:X>Y>Z | B.X、Y都能与Z形成离子键 |
| C.最简单氢化物的稳定性:W>X | D.Y的最简单氢化物的空间结构是直线形 |
您最近一年使用:0次
2024-05-28更新
|
71次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
13. 在标准状态下,由最稳定的单质合成1mol某物质的焓变叫做该物质的标准摩尔生成焓,用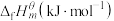 表示,最稳定单质的标准摩尔生成焓为0,有关物质的
表示,最稳定单质的标准摩尔生成焓为0,有关物质的 如图所示。下列说法正确的是
如图所示。下列说法正确的是
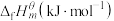 表示,最稳定单质的标准摩尔生成焓为0,有关物质的
表示,最稳定单质的标准摩尔生成焓为0,有关物质的 如图所示。下列说法正确的是
如图所示。下列说法正确的是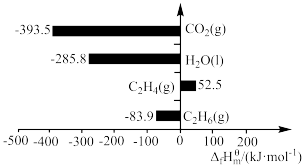
A.标准状态下, 比 比 稳定 稳定 |
B. 的 的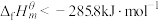 |
C.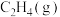 的摩尔燃烧焓为-1411.1 的摩尔燃烧焓为-1411.1 |
D.1mol 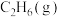 的键能大于2mol 的键能大于2mol  与3mol 与3mol  的键能之和 的键能之和 |
您最近一年使用:0次
2024-05-28更新
|
171次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
四、多选题 添加题型下试题
14. 钠离子电池主要依靠钠离子在正极和负极之间移动来工作,具有安全性能高,充电速度快等优点。一种以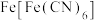 为正极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
为正极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
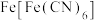 为正极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
为正极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是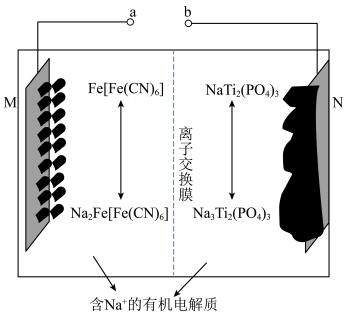
| A.充电时,电极电势:M<N |
B.放电时, 通过离子交换膜从右室移向左室 通过离子交换膜从右室移向左室 |
C.充电时,阳极反应式为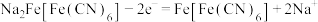 |
D.若初始两电极质量相等,当转移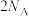 个电子时,两电极质量差为46g 个电子时,两电极质量差为46g |
您最近一年使用:0次
2024-05-28更新
|
125次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
五、单选题 添加题型下试题
单选题
|
适中(0.65)
15. T℃时,2L恒容密闭容器中A、B发生反应: ,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
 ,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是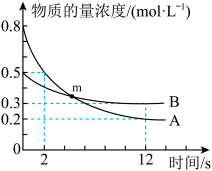
A. , , | B.0~12s,C的平均反应速率为0.05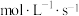 |
C.m点, | D.2s末时,D的物质的量浓度为0.2 |
您最近一年使用:0次
2024-05-28更新
|
410次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
六、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
解题方法
16. 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经150多年。如图是元素周期表的一部分。
回答下列问题:
(1)写出 的离子结构示意图
的离子结构示意图______ 。Q的最高正价为______ ;D的气态氢化物为______ (填化学式)。
(2)元素Y在元素周期表中的位置为______ ,其元素性质与Al相似,写出Y的氧化物溶解在NaOH溶液中的离子方程式______ 。
(3)上述元素最简单氢化物热稳定性最高的是______ 元素(填元素符号)。D、M的最高价含氧酸的酸性由强到弱的顺序是______ (用化学式表示)。
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱______ (填标号)。
(可供选择的药品有:A. 固体 B.稀硫酸 C.盐酸 D.饱和
固体 B.稀硫酸 C.盐酸 D.饱和 溶液 E.硅酸钠溶液)
溶液 E.硅酸钠溶液)
(5)M、Z可化合形成化合物,应用于未来超算设备的新型半导体材料,其化学式为______ 。
B | C | N | O | F |
Al | Si | Cl | ||
Y | D | M | ||
Z | Q |
(1)写出
 的离子结构示意图
的离子结构示意图(2)元素Y在元素周期表中的位置为
(3)上述元素最简单氢化物热稳定性最高的是
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱
(可供选择的药品有:A.
 固体 B.稀硫酸 C.盐酸 D.饱和
固体 B.稀硫酸 C.盐酸 D.饱和 溶液 E.硅酸钠溶液)
溶液 E.硅酸钠溶液)(5)M、Z可化合形成化合物,应用于未来超算设备的新型半导体材料,其化学式为
您最近一年使用:0次
2024-05-28更新
|
60次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
解答题-实验探究题
|
较易(0.85)
解题方法
17. 某同学利用以下装置制备氯气,探究卤族元素性质的递变规律并验证氯气的性质。
(1)在装置A中利用高锰酸钾和浓盐酸制备氯气,反应的化学方程式是______ ,装置E中的试剂是______ (填化学式)溶液。
(2)能说明氧化性 的实验现象为
的实验现象为______ 。氯气进入D中反应的离子方程式为______ 。
(3)下列性质递变规律正确且能作为非金属性强弱判断依据的是______。(填标号)
(4)为探究卤族元素非金属性Cl>Br>I,你认为该实验装置存在的缺陷是______ 。
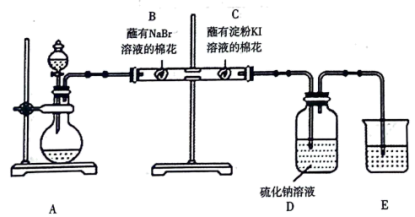
(1)在装置A中利用高锰酸钾和浓盐酸制备氯气,反应的化学方程式是
(2)能说明氧化性
 的实验现象为
的实验现象为(3)下列性质递变规律正确且能作为非金属性强弱判断依据的是______。(填标号)
| A.氯溴碘对应最高价含氧酸酸性逐渐减弱 | B. 、 、 、 、 熔点逐渐升高 熔点逐渐升高 |
C. 、 、 、 、 还原性增强 还原性增强 | D.HCl、HBr、HI酸性增强 |
您最近一年使用:0次
2024-05-22更新
|
32次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
解答题-原理综合题
|
较难(0.4)
解题方法
18. 二氧化锰是实验室常见的氧化剂,在化学领域应用广泛。回答下列问题:
(1)将C和 的混合物在空气中灼烧可发生以下反应:
的混合物在空气中灼烧可发生以下反应:
Ⅰ.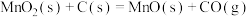
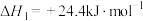
Ⅱ.

Ⅲ.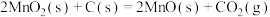

①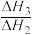 的数值范围是
的数值范围是______ (填标号)。
a.<-l b.-1~0 c.0~1 d.>1
②反应Ⅲ可看成由反应Ⅰ和反应Ⅱ两步进行,画出由原料经两步生皮产物的反应过程能量变化示意图______ 。 可催化分解
可催化分解 :
:
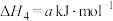 ,其应机理如图:
,其应机理如图: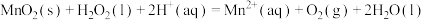
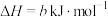 ,写出反应Ⅱ的热化学方程式
,写出反应Ⅱ的热化学方程式______ (焓变数值用a和b表示)。
(3)一种水性电解液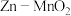 电池如图所示,电池放电时可以制备
电池如图所示,电池放电时可以制备 。已知:KOH溶液中,
。已知:KOH溶液中, 以
以 形式存在。
形式存在。______ (填“阴”或“阳”)离子交换膜。
②电池总反应为______ 。
③放电时,6.5g Zn参加反应,Ⅰ室溶液质量理论上减少______ g。
(1)将C和
 的混合物在空气中灼烧可发生以下反应:
的混合物在空气中灼烧可发生以下反应:Ⅰ.
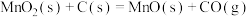
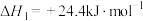
Ⅱ.


Ⅲ.
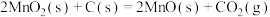

①
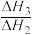 的数值范围是
的数值范围是a.<-l b.-1~0 c.0~1 d.>1
②反应Ⅲ可看成由反应Ⅰ和反应Ⅱ两步进行,画出由原料经两步生皮产物的反应过程能量变化示意图

 可催化分解
可催化分解 :
:
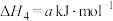 ,其应机理如图:
,其应机理如图: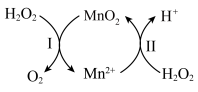
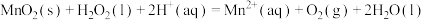
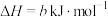 ,写出反应Ⅱ的热化学方程式
,写出反应Ⅱ的热化学方程式(3)一种水性电解液
 电池如图所示,电池放电时可以制备
电池如图所示,电池放电时可以制备 。已知:KOH溶液中,
。已知:KOH溶液中, 以
以 形式存在。
形式存在。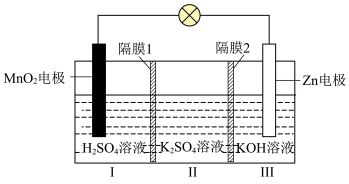
②电池总反应为
③放电时,6.5g Zn参加反应,Ⅰ室溶液质量理论上减少
您最近一年使用:0次
2024-05-28更新
|
168次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
解答题-实验探究题
|
适中(0.65)
19. 室温下,将 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: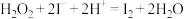 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。
回答下列问题:
(1)反应B的离子方程式是______ 。 的作用为
的作用为______ 。
(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
①实验Ⅰ中,若2s时 的浓度变为
的浓度变为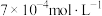 ,则0~2s时
,则0~2s时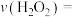
______ 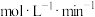
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则
______ ;实验Ⅲ和实验Ⅳ对照实验的目的为______ ;若探究温度对溶液颜色第一次变蓝快慢的影响因素,可选择实验______ 和实验______ (填写“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: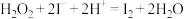 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。回答下列问题:
(1)反应B的离子方程式是
 的作用为
的作用为(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
试剂用量(mL) 序号 | 温度 | 0.01 | 0.01 | 0.01 | 0.01 |
|
Ⅰ | 25℃ | 5 | 4 | 8 | 3 | 0 |
Ⅱ | 25℃ | 5 | 2 | x | y | z |
Ⅲ | 35℃ | 5 | 4 | 8 | 3 | 0 |
Ⅳ | 35℃ | 3 | 4 | 8 | 3 | 2 |
 的浓度变为
的浓度变为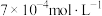 ,则0~2s时
,则0~2s时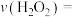
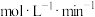
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则

您最近一年使用:0次
2024-05-28更新
|
87次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
解答题-工业流程题
|
适中(0.65)
解题方法
20. 天青石主要成分为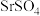 ,含有
,含有 、
、 、FeO等杂质,以天青石为原料生产
、FeO等杂质,以天青石为原料生产 的流程如下:
的流程如下: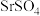 转变为
转变为 。
。
(1)“转化”工序中,为提高速率可采取的措施有______ (任写一条即可)。
(2)“滤液2”的主要成分有NaOH、 和
和______ (写化学式,下同),试剂A为______ 。
(3)“氧化”工序发生反应的离子方程式为______ 。
(4)“调pH”所得溶液含有较多NaCl,为得到更纯净的 溶液.应采取的操作为:蒸发浓缩至有固体析出,
溶液.应采取的操作为:蒸发浓缩至有固体析出,______ 。 的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的
的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的 溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中
溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中______ (填标号), 的纯度是
的纯度是______ (用含m、n的代数式表示)。
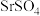 ,含有
,含有 、
、 、FeO等杂质,以天青石为原料生产
、FeO等杂质,以天青石为原料生产 的流程如下:
的流程如下: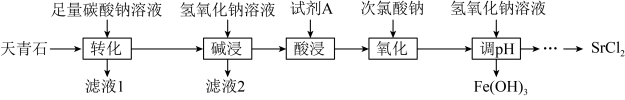
 转变为
转变为 。
。(1)“转化”工序中,为提高速率可采取的措施有
(2)“滤液2”的主要成分有NaOH、
 和
和(3)“氧化”工序发生反应的离子方程式为
(4)“调pH”所得溶液含有较多NaCl,为得到更纯净的
 溶液.应采取的操作为:蒸发浓缩至有固体析出,
溶液.应采取的操作为:蒸发浓缩至有固体析出,
 的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的
的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的 溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中
溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中 的纯度是
的纯度是
您最近一年使用:0次
2024-05-28更新
|
143次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
试卷分析
整体难度:适中
考查范围:物质结构与性质、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础、化学与STSE
试卷题型(共 20题)
题型
数量
单选题
13
多选题
2
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 原子中相关数值及其之间的相互关系 元素、核素、同位素 | |
| 2 | 0.85 | 共价化合物的结构及形成过程 电子式的书写与判断 电离方程式 离子键的实质与形成 | |
| 3 | 0.85 | 化学反应中能量变化的原因 吸热反应和放热反应 | |
| 4 | 0.85 | 氧化性、还原性强弱的比较 中和热的测定与误差分析 利用原电池原理比较金属活动性强弱 氯碱工业 | |
| 5 | 0.65 | 二氧化硅的用途 元素非金属性强弱的比较方法 微粒半径大小的比较方法 | |
| 6 | 0.65 | 金属的电化学腐蚀与防护 氢氧燃料电池 电镀 铜的电解精炼 | |
| 7 | 0.65 | 化学实验方案的设计与评价 物质制备的探究 | |
| 8 | 0.65 | 氧化还原反应定义、本质及特征 蒸馏与分馏 海带中碘的提取及检验 | |
| 9 | 0.65 | 氧化性、还原性强弱的比较 同周期元素性质递变规律理解及应用 同主族元素性质递变规律理解及应用 微粒半径大小的比较方法 | |
| 10 | 0.65 | 金属的电化学腐蚀与防护 金属的化学腐蚀与电化学腐蚀 | |
| 11 | 0.65 | 焰色试验 氢氧化铝与强碱反应 催化剂对化学反应速率的影响 利用原电池原理比较金属活动性强弱 | |
| 13 | 0.65 | 化学能与物质稳定性之间的关系 燃烧热概念 盖斯定律与热化学方程式 | |
| 15 | 0.65 | 化学反应速率计算 化学反应速率与化学计量数之间的关系 | |
| 二、多选题 | |||
| 12 | 0.65 | 元素非金属性强弱的比较方法 微粒半径大小的比较方法 化学键与物质类别关系的判断 利用杂化轨道理论判断分子的空间构型 | |
| 14 | 0.65 | 原电池原理理解 原电池电极反应式书写 新型电池 | |
| 三、解答题 | |||
| 16 | 0.65 | 原子结构示意图、离子结构示意图 元素周期表提供的元素信息 同主族元素性质递变规律理解及应用 元素非金属性强弱的比较方法 | 无机推断题 |
| 17 | 0.85 | 氯气的化学性质 氯气的实验室制法 同主族元素性质递变规律理解及应用 | 实验探究题 |
| 18 | 0.4 | 盖斯定律与热化学方程式 原电池电极反应式书写 原电池有关计算 | 原理综合题 |
| 19 | 0.65 | 影响化学反应速率的因素 化学反应速率计算 外因对化学反应速率影响的综合分析 | 实验探究题 |
| 20 | 0.65 | 化学实验基本操作 物质分离、提纯综合应用 探究物质组成或测量物质的含量 | 工业流程题 |




