2024高三下·全国·专题练习
解题方法
1 . 对于基元反应,如aA+bB cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
反应Ⅱ:8NH3(g)+6NO2(g) 7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)ΔH3=+182.6kJ·mol-1
对于基元反应Ⅳ:2NO(g)+O2(g) 2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
(1)ΔH4=______ kJ·mol-1
(2)计算653K时的平衡常数K=______ 。
(3)653K时,若NO的浓度为0.006mol·L-1,O2的浓度为0.290mol·L-1,则正反应速率为______ mol·L-1·s-1
 cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:反应Ⅰ:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1反应Ⅱ:8NH3(g)+6NO2(g)
 7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1反应Ⅲ:N2(g)+O2(g)=2NO(g)ΔH3=+182.6kJ·mol-1
对于基元反应Ⅳ:2NO(g)+O2(g)
 2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1(1)ΔH4=
(2)计算653K时的平衡常数K=
(3)653K时,若NO的浓度为0.006mol·L-1,O2的浓度为0.290mol·L-1,则正反应速率为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 空气中CO2含量的控制和CO2资源利用具有重要意义。
(1)已知25℃、101 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
该反应的速率方程为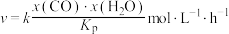 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后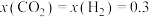 ,此时反应Ⅰ的速率
,此时反应Ⅰ的速率
______  (用含k的代数式表示)。
(用含k的代数式表示)。
(1)已知25℃、101
 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1该反应的速率方程为
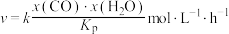 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后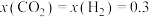 ,此时反应Ⅰ的速率
,此时反应Ⅰ的速率
 (用含k的代数式表示)。
(用含k的代数式表示)。
您最近一年使用:0次
3 . 已知: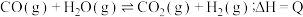 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。
(1)上述反应的化学平衡常数表达式为
___________ 。
(2) 时,向体积为
时,向体积为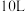 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
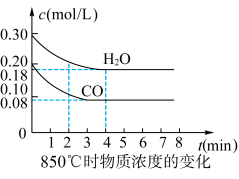
和 浓度变化如图所示,则
浓度变化如图所示,则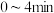 时,平均反应速率
时,平均反应速率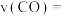
___________ 。
(3)若在 时进行,且
时进行,且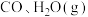 的起始浓度均为
的起始浓度均为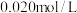 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为___________
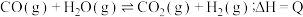 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。温度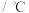 | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为

(2)
 时,向体积为
时,向体积为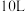 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则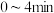 时,平均反应速率
时,平均反应速率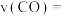

(3)若在
 时进行,且
时进行,且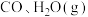 的起始浓度均为
的起始浓度均为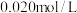 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为
您最近一年使用:0次
4 . 以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率 (H2)=
(H2)=_______ ,当平衡时c(N2)=_______ ,此时H2的转化率为_______ %,此条件下该反应的平衡常数为_______ 。
(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
(3)若在上述2L的密闭容器中,一定量的氮气和氢气发生上述反应,其化学平衡常数K与温度T的关系如表所示:
①试比较K1、K2的大小,K1_______ K2(填“>”、“<”或“=”);
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向_______ 进行(填“正反应”、“逆反应”或“已平衡”)。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率
 (H2)=
(H2)=(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 | C.降低反应体系的温度 | D.加入一定量N2 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向
您最近一年使用:0次
名校
解题方法
5 . 将等物质的量的A、B混合于2升的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g),经2min后测得D的浓度为0.5mol•L-1,c(A):c(B)=3:5,以C表示的平均反应速率v(C)=0.25mol•L-1•min-1。求(要求写出计算过程):
(1)v(B)=________ 。
(2)x=________ 。
(3)2min时A的物质的量浓度为_________ 。
(1)v(B)=
(2)x=
(3)2min时A的物质的量浓度为
您最近一年使用:0次
名校
解题方法
6 . 一定在条件下,容积为2L的密闭容器中,将2molL气体和3molM气体混合,发生如下反应: ,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:
,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:
(1)平衡时,L和M的转化率比值为___________ 。
(2)前10s内用M表示的化学反应速率为___________ 。
(3)化学方程式中x值为___________ 。
(4)在恒温恒容条件下,往容器中加入1mol氦气,反应速率___________ (填“增大”、“减小”或“不变”)。
(5)平衡时压强与初始压强之比为___________ (整数比)。
 ,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:
,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:(1)平衡时,L和M的转化率比值为
(2)前10s内用M表示的化学反应速率为
(3)化学方程式中x值为
(4)在恒温恒容条件下,往容器中加入1mol氦气,反应速率
(5)平衡时压强与初始压强之比为
您最近一年使用:0次
2023-10-26更新
|
103次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高二上学期10月月考化学试题
23-24高二上·全国·期中
解题方法
7 . 某温度下,在2 L密闭容器中进行反应:mX(g)+nY(g)⇌ pZ(g)+qQ(g),式中m、n、p、q为物质的化学计量数。在0~3 min内,各物质的物质的量变化如表所示:
已知2 min内v(Q)=0.075 mol·L-1·min-1,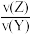 =1/2。
=1/2。
(1)试确定以下物质的相关量:起始时n(Y)=_______ ,n(Q)=_______ 。
(2)化学方程式中m=_______ ,n=_______ ,p=_______ ,q=_______ 。
(3)用Z表示2 min内的反应速率:_______ 。
(4)2 min末Q的转化率为_______ 。
物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | 0.8 |
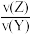 =1/2。
=1/2。(1)试确定以下物质的相关量:起始时n(Y)=
(2)化学方程式中m=
(3)用Z表示2 min内的反应速率:
(4)2 min末Q的转化率为
您最近一年使用:0次
解题方法
8 . 无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)⇌2NO2(g) ΔH=+24.4 kJ·mol-1。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______ (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______ kPa·s-1。
您最近一年使用:0次
解题方法
9 . 已知2N2O5(g)=2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=_______ kPa,v=_______ kPa·min-1。
您最近一年使用:0次
名校
10 . 完成下列问题
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.0 mL。大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应: 3A(g)+B(g) xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(2)达到平衡时B的转化率为___________ 。
(3)x的值为___________ 。
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.0 mL。大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度/℃ | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响 |
| ② | 25 | 粗颗粒 | (Ⅱ)实验①和③探究温度对反应速率的影响; | |
| ③ | 粗颗粒 | 2.00 | (Ⅲ)实验①和④探究 | |
| ④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应: 3A(g)+B(g)
 xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:(2)达到平衡时B的转化率为
(3)x的值为
您最近一年使用:0次



