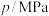(1)已知:①碳的燃烧热为393.5

②
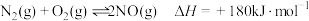
则
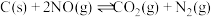 的
的
 。
。(2)用焦炭还原
 的反应为:
的反应为: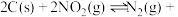
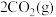 ,向两个容积均为
,向两个容积均为 、反应温度分别为
、反应温度分别为 、
、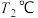 的恒温恒容密闭容器中分别加入足量的焦炭和一定量的
的恒温恒容密闭容器中分别加入足量的焦炭和一定量的 ,测得各容器中
,测得各容器中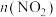 随反应时间
随反应时间 的变化情况如图所示;
的变化情况如图所示;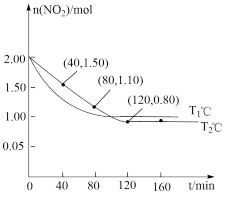
②
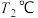 时,
时,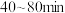 ,用
,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为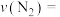
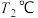 时该反应的化学平衡常数
时该反应的化学平衡常数
 。
。③
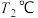 下,
下,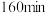 时,向容器中再加入焦炭和
时,向容器中再加入焦炭和 各
各 ,平衡向
,平衡向 的转化率比原平衡
的转化率比原平衡(3)工业上除去氮氧化物的反应为:

①用该法除NO,投料比一定时提高NO平衡转化率的方法有
②反应温度过高,会发生以下副反应:
 ;
; ;某科研小组通过系列实验,分析得出脱硝率与氨氮比[
;某科研小组通过系列实验,分析得出脱硝率与氨氮比[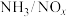 表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是
表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是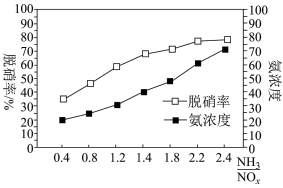
2 . 苯甲醛(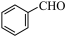 )是生产氨苄青霉素、某些苯胺染料等产品的重要中间体。制备苯甲醛的常用方法有气相催化氧化法和电催化氧化法。
)是生产氨苄青霉素、某些苯胺染料等产品的重要中间体。制备苯甲醛的常用方法有气相催化氧化法和电催化氧化法。
I.气相催化氧化法(以Ce/ZSM-5为催化剂)主要反应: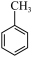 (g)+O2(g)
(g)+O2(g)
 (g)+H2O(g) ΔH
(g)+H2O(g) ΔH
①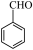 (g)+ 8O2(g)=7CO2(g)+3H2O(g) ΔH=-3452.6kJ/mol
(g)+ 8O2(g)=7CO2(g)+3H2O(g) ΔH=-3452.6kJ/mol
② (g)+9O2(g)= 7CO2(g)+4H2O(g) ΔH=-3784.9kJ/mol
(g)+9O2(g)= 7CO2(g)+4H2O(g) ΔH=-3784.9kJ/mol
则反应 (g)+ O2(g)
(g)+ O2(g)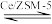
 (g) +H2O(g) ΔH=
(g) +H2O(g) ΔH=
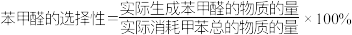



(3)其他条件相同、不同空速下测得苯甲醛的选择性和收率如图所示。
已知:①空缝指鼓入空气的速度,单位为h-1;
②苯甲醛只有吸附在催化剂表面才能被进一步氧化为苯甲酸。
据以上信息,分析空缝由1000h-1增大至2500h-1过程中苯甲醛选择性增加的原因:
(4)合成苯甲醛的最佳温度和空速应为___________(填序号)。
| A.350℃、5000h-1 | B.350℃、2500h-1 |
| C.410℃、5000h-1 | D.410℃、2500h-1 |
II.电催化氧化法
以硫酸酸化的MnSO4溶液作为电解媒质间接氧化甲苯制备苯甲醛的工艺方案如图所示:
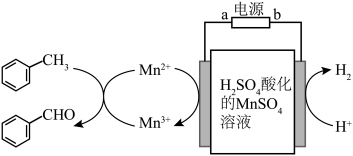
 。
。
 与
与 反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:
反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题: .该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示。
.该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示。| 编号 | 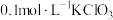 溶液体积/mL 溶液体积/mL |  液体积/mL 液体积/mL | 加水的体积/mL | 温度 |
| 1 | 10 | 10 | 0 | 25℃ |
| 2 | 10 | 5 | a | 25℃ |
| 3 | 10 | 10 | 0 | 60℃ |
(1)表中

(2)写出
 与
与 反应的离子方程式:
反应的离子方程式: .该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示。
.该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示。
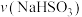 为
为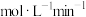 。
。分析实验数据发现,反应过程中该反应的化学反应速率先增大后减小,探究化学反应速率先增大的原因,具体情况如表所示。
| 方案 | 假设 | 实验操作 |
| 1 | 该反应放热,使溶液温度升高,化学反应速率加快 | 向烧杯中加入10mL 溶液和10mL 溶液和10mL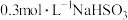 溶液,插入温度计,测量温度变化 溶液,插入温度计,测量温度变化 |
| 2 | 另取10mL 溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL 溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL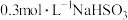 溶液。 溶液。 |
(4)方案2中的假设为
(5)除方案1、2中的假设外,还可提出的假设是
(6)反应后期化学反应速率减小的主要原因是
 合成化工制成品是实现碳中和重要途径之一、利用二氧化碳合成二甲醚
合成化工制成品是实现碳中和重要途径之一、利用二氧化碳合成二甲醚 (DMC)的主要反应有:
(DMC)的主要反应有:Ⅰ.

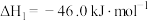
Ⅱ.
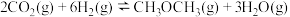
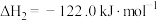
(1)
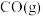 和
和 为原料制备气态
为原料制备气态 和水蒸气的热化学方程式是
和水蒸气的热化学方程式是(2)对于基元反应
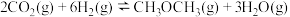 ,若升高反应温度,平衡常数K
,若升高反应温度,平衡常数K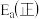
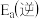 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。已知:阿伦尼乌斯经验公式为
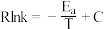 ,其中:
,其中: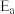 为正、逆反应的活化能,k为正、逆反应速率常数,R和C为常数。某实验小组依据实验数据获得如图曲线。曲线中表示正反应速率的是
为正、逆反应的活化能,k为正、逆反应速率常数,R和C为常数。某实验小组依据实验数据获得如图曲线。曲线中表示正反应速率的是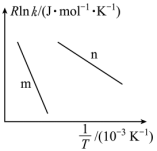

 、
、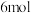
 ,同时发生上述两个反应,装置中压强p随着时间t变化如下表:
,同时发生上述两个反应,装置中压强p随着时间t变化如下表:
| 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 16 | 13.4 | 12.8 | 12.4 | 12.2 | 12 | 12 |

 ,若其他条件不变,向该体系中充入
,若其他条件不变,向该体系中充入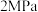
 ,则
,则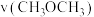
②平衡时测得水蒸气分压
 ,反应Ⅱ生成
,反应Ⅱ生成 的选择性为
的选择性为 选择性
选择性 ,保留1位小数)。
,保留1位小数)。③计算反应Ⅰ的压强平衡常数

(4)“直接二甲醚(
 )燃料电池”被称为绿色电源,其工作原理如图所示,写出A电极的电极反应式
)燃料电池”被称为绿色电源,其工作原理如图所示,写出A电极的电极反应式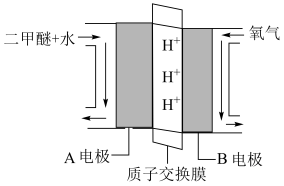
(1)氨的催化氧化是制备硝酸的重要反应,实验中先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是
A.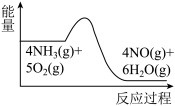 B.
B.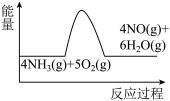 C.
C.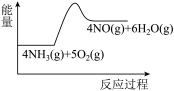
 ,通入等物质的量的NO和
,通入等物质的量的NO和 气体,
气体,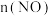 随时间的变化如下表:
随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
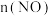 /(×10-3mol) /(×10-3mol) | 2.0 | 1.2 | 0.8 | 0.5 | 0.4 | 0.4 |
②某同学由数据推测,反应在第4s时恰好达到平衡状态。该推测
③在第5s时,
 的转化率为
的转化率为④平衡时,容器中混合气体的压强与反应开始时的压强之比为
能判断该反应已经达到化学平衡的是
A.2v(NO)正=v(O2)逆
B.密闭容器中气体的颜色不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼(N2H4)—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,
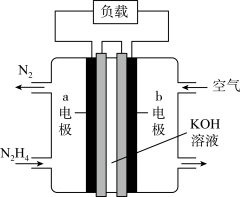
②电池工作时,
 移向
移向③空气中氧气的体积分数为20%,当电池负极消耗19.2g肼(N2H4)时,消耗标准状况下空气的体积为
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)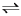 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =
(2)若在
A.
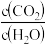 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)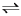 H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为
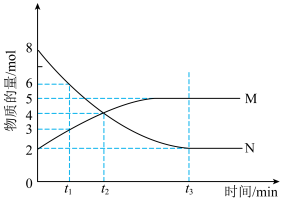
(2)t1、t2、t3三个时刻中,处于平衡状态的为
(3)平衡后容器中气体的压强和反应前气体的压强之比为
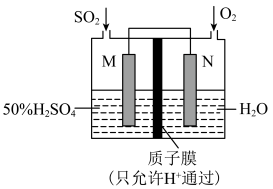
(4)可用电化学原理处理SO2制备硫酸,装置图如下图,电极为多孔材料,M极的电极反应式
(1)1886年法国化学家莫瓦桑首次通过电解熔融的氟氢化钾(
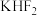 )制备
)制备 ,两极均有气体产生。装置如图所示,钢电极与电源的
,两极均有气体产生。装置如图所示,钢电极与电源的
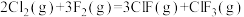
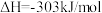 ;F-Cl(ClF中)的键能为248kJ/mol,F-Cl(
;F-Cl(ClF中)的键能为248kJ/mol,F-Cl( 中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为
中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为(3)氟单质的氧化性很强,可与稀有气体氙(Xe)同时发生如下三个反应。
| 标准平衡常数 | 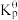 (523K) (523K) | 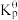 (673K) (673K) |
ⅰ.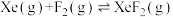 | 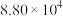 | 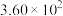 |
ⅱ. | 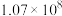 | 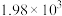 |
ⅲ. | 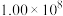 | 36 |
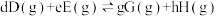 ,
,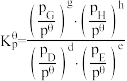 ,其中
,其中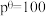 kPa,
kPa,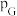 、
、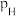 、
、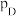 、
、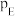 为各组分的平衡分压。
为各组分的平衡分压。①在恒温、恒容条件下,向密闭容器中通入一定量的Xe和
 ,下列有关说法不正确的是
,下列有关说法不正确的是A.当混合气体的密度不变时,体系达到平衡
B.当Xe与
 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于XeC.达到平衡后将
 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动D.反应ⅰ、ⅱ、ⅲ均为放热反应
②在600K条件下,向体积为2L的密闭容器中通入30.0mol Xe和60.0mol
 ,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为
,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为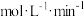 ,
, 的转化率为
的转化率为| 物质 |  |  | 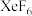 |
| n/mol | 3.6 | 17.4 | 0.4 |
 制取
制取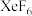 。反应达到平衡时,欲使产物
。反应达到平衡时,欲使产物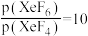 ,
, 的分压为
的分压为Ⅰ.雾霾严重影响人们的生活,雾霾的形成与汽车排放的
 等有毒气体有关。
等有毒气体有关。(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g)
 N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是
N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是A.
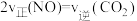 B.混合气体中
B.混合气体中 的体积分数保持不变
的体积分数保持不变C.单位时间内断裂1个
 同时生成1个C=O D.恒温、恒容条件下,混合气体的密度保持不变
同时生成1个C=O D.恒温、恒容条件下,混合气体的密度保持不变E.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
(2)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)
 N2(g)+2CO2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
N2(g)+2CO2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。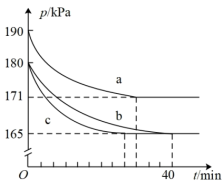
②实验a中NO的平衡转化率为
③与实验b相比,实验c改变的条件是
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,
(3)回答下列问题:
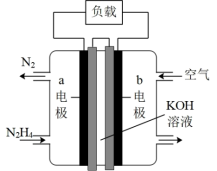
②电池工作时,
 移向
移向③当电池放电转移10mol电子时,至少消耗燃料肼
I.O3氧化法
(1)用O3氧化烟气中的SO2时,体系中存在以下反应:
a)SO2(g)+O3(g)⇌SO3(g)+O2(g) △H1=-241.6kJ/mol K1
b)2O3(g)⇌3O2(g) △H2=-286.6kJ/mol K2
c)2SO2(g)+O2(g)⇌2SO3(g) △H3 K3
根据盖斯定律,△H3=
(2)在密闭容器中充入1molN2O4和1molO3,发生以下反应:
d)N2O4(g)⇌2NO2(g) △H4=+57kJ/mol
e)N2O4(g)+O3(g)⇌N2O5(g)+O2(g) △H5
不同压强(P)下,N2O4平衡转化率α(N2O4)随反应温度(T)的变化关系如图1所示。

②下列有关该反应体系的说法正确的是
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在n(NO2)+n(N2O4)+n(N2O5)>1mol
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大N2O4的浓度,反应d的正反应速率增大,e的正反应速率减小
③某温度下,t分钟后达到平衡,此时N2O4的物质的量分数为1/3,且NO2与O2的物质的量分数相等,v(O2)=
Ⅱ.光催化氧化法
光照条件下,催化剂TiO2表面产生电子(e-)和空穴(h+)。电子与O2作用生成离子自由基(·O
 ),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO
),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO 。变化过程如图2所示。
。变化过程如图2所示。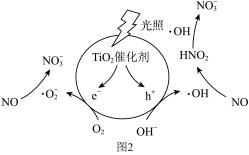
(4)已知该过程中生成的HNO2可继续与·OH发生反应:HNO2+2·OH=H++NO
 +H2O;该反应可分两步进行,请补充反应i:
+H2O;该反应可分两步进行,请补充反应i:i:
ii.NO2+·OH=H++NO
 。
。