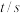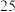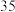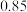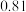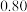1 . t ℃时,将2mol A 和 6 mol B 充入容积固定为 2 L 的密闭容器中发生反应: A(g)+2B(g)  2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
(1)第 2 min 到第 4 min 内 A 的平均反应速率为_______
(2)t ℃时该反应的平衡常数为_______
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=_______ 。(写出三个题 完整计算过程,无计算过程不给分)
 2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:(1)第 2 min 到第 4 min 内 A 的平均反应速率为
(2)t ℃时该反应的平衡常数为
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=
您最近一年使用:0次
解题方法
2 . 请回答下列问题
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+ O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为_____ kJ•mol-1(用含a、b、c的式子表示)。
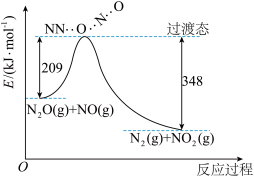
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为_____ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①H2S的平衡转化率α=_____ %,反应平衡常数K=______ 。
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡______ (填“是”或“否”),此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+
 O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为

(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①H2S的平衡转化率α=
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡
您最近一年使用:0次
名校
3 . 20℃时,将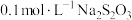 溶液与
溶液与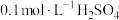 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: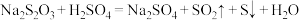 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?_______
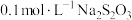 溶液与
溶液与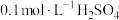 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: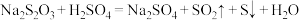 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
您最近一年使用:0次
2022-11-25更新
|
457次组卷
|
3卷引用:四川省江油中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
4 . 工业制备硫酸的主要反应之一为SO2与O2反应生成SO3。请回答下列问题:
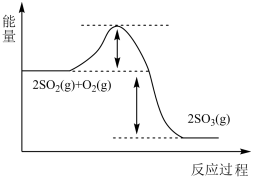
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为_______ (填“放热”或“吸热”)反应。
(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。
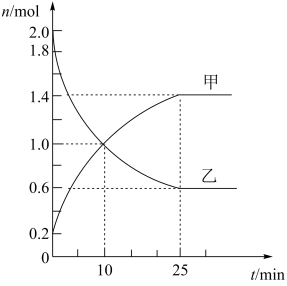
①甲为_______ (填化学式,下同),乙为_______ 。
②SO2与O2反应生成SO3的反应是_______ (填“可逆”或“不可逆”)反应。
③10 min时,v正(SO2)_______ (填“>”“<”或“=”)v逆(SO2)。
④从反应开始到平衡,反应速率v(SO3)_______ mol·L-1·min-1。
⑤反应达到平衡时,SO2的转化率为_______ 。
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为

(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。

①甲为
②SO2与O2反应生成SO3的反应是
③10 min时,v正(SO2)
④从反应开始到平衡,反应速率v(SO3)
⑤反应达到平衡时,SO2的转化率为
您最近一年使用:0次
解题方法
5 . 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)此时A的浓度c(A)=_______ mol/L
(2)前5min内用B表示的平均反应速率v(B)=_______ mol/(L·min);
(3)化学反应方程式中x的值为_______ 。
(1)此时A的浓度c(A)=
(2)前5min内用B表示的平均反应速率v(B)=
(3)化学反应方程式中x的值为
您最近一年使用:0次
6 . 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
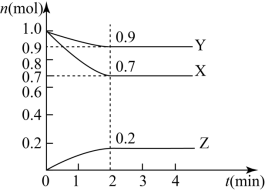
(1)X的转化率是___________ ;
(2)由图中所给数据进行分析,该反应的化学方程式为___________ ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=___________ .

(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=
您最近一年使用:0次
2021-03-31更新
|
183次组卷
|
3卷引用:四川省平昌县驷马中学2020-2021学年下学期高二第一次月考化学试题
7 . 一定温度下,向 恒容容器中充入
恒容容器中充入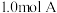 和
和 ,发生反应
,发生反应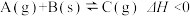 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
(1)前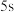 的平均反应速率
的平均反应速率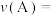
_______ ,达平衡时 的平衡体积分数为
的平衡体积分数为_______ 。
(2)由表中数据计算该温度下该反应的平衡常数为_______ ,随着反应温度升高,该反应的平衡常数_______ (选填“增大”、“减小”或“不变”)。
(3)保持温度不变,起始时向容器中充入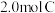 ,达平衡时,
,达平衡时, 的转化率为
的转化率为_______ 。
 恒容容器中充入
恒容容器中充入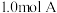 和
和 ,发生反应
,发生反应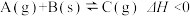 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
|
|
|
|
|
|
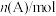 |
|
|
|
|
|
(1)前
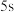 的平均反应速率
的平均反应速率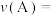
 的平衡体积分数为
的平衡体积分数为(2)由表中数据计算该温度下该反应的平衡常数为
(3)保持温度不变,起始时向容器中充入
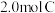 ,达平衡时,
,达平衡时, 的转化率为
的转化率为
您最近一年使用:0次
2021-02-03更新
|
212次组卷
|
2卷引用:四川省乐山市2020-2021学年高二上学期期末考试化学试题
名校
8 . 已知N2O4(g) 2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)20s时,N2O4的分解率是___ 。
(2)40s时,NO2的浓度为___ ,0~40s内N2O4的平均反应速率为____ 。
(3)在80℃时该反应的平衡常数K值为___ 。
(4)判断t2、t3、t4时刻对该反应采取的措施。
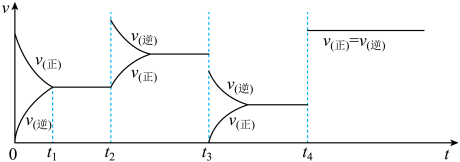
t2:___ ;t3:___ ;t4:___ 。
 2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.12 | c | d | e |
| c(NO2) | 0.00 | 0.08 | b | 0.20 | 0.20 | 0.20 |
(1)20s时,N2O4的分解率是
(2)40s时,NO2的浓度为
(3)在80℃时该反应的平衡常数K值为
(4)判断t2、t3、t4时刻对该反应采取的措施。

t2:
您最近一年使用:0次
名校
9 . Ⅰ.某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
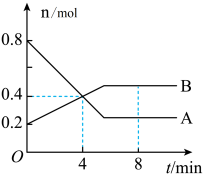
(1)在4 min末时,A、B的物质的量浓度c(A)___ c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)____ Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为_____________ 。
(3)该反应的化学方程式为___________________________________ 。
Ⅱ.将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:2A(g)+B(g)===x C(g)+2D(g),经5 min后,测得D的浓度为0.4 mo·L-1,c(A)∶c(B)=3∶4,C的平均反应速率为0.04 mol·L-1·min-1。求:
(1)5min时,A的体积分数=______ 。
(2)前5 min内B的转化率=______ 。
(3)化学反应方程式中x的值为_________

(1)在4 min末时,A、B的物质的量浓度c(A)
(2)从反应开始至4 min时,A的平均反应速率为
(3)该反应的化学方程式为
Ⅱ.将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:2A(g)+B(g)===x C(g)+2D(g),经5 min后,测得D的浓度为0.4 mo·L-1,c(A)∶c(B)=3∶4,C的平均反应速率为0.04 mol·L-1·min-1。求:
(1)5min时,A的体积分数=
(2)前5 min内B的转化率=
(3)化学反应方程式中x的值为
您最近一年使用:0次
2020-10-12更新
|
166次组卷
|
2卷引用:四川省广安第二中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
10 . (1)化学反应速率和限度与生产、生活密切相关。
某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大?________ min(填0~1、1~2、2~3、3~4、4~5)。
②另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是________ 。
A.蒸馏水 B.KCl溶液 C.将锌磨成粉 D.CuSO4溶液
(2)某温度时,在一个10 L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①反应开始至2 min,以气体X表示的平均反应速率为__________ 。
②该反应的化学方程式为__________ 。
③2 min内Y的转化率为___________ 。
某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
②另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是
A.蒸馏水 B.KCl溶液 C.将锌磨成粉 D.CuSO4溶液
(2)某温度时,在一个10 L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①反应开始至2 min,以气体X表示的平均反应速率为
②该反应的化学方程式为
③2 min内Y的转化率为
您最近一年使用:0次