1 . 氮氧化物( 、
、 等)的处理和资源化利用具有重要意义。
等)的处理和资源化利用具有重要意义。
(1) 的处理。研究证明:
的处理。研究证明: 能提高
能提高 的分解速率,
的分解速率, 参与了第Ⅱ步、第Ⅲ步反应。反应历程(
参与了第Ⅱ步、第Ⅲ步反应。反应历程( 为反应活化能):
为反应活化能):
第Ⅰ步:
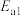
第Ⅱ步:……
第Ⅲ步: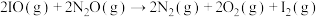
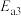
①第Ⅱ步发生反应的方程式为___________ 。
②总反应的反应速率取决于第Ⅱ步,则
___________ 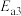 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 的应用。
的应用。 分解
分解 制取
制取 和
和 的原理如下:
的原理如下:
反应Ⅰ:

反应Ⅱ: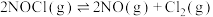

反应的 (
( 值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。

①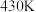 时,反应
时,反应 的
的 为
为___________ 。
② 时,向容积不变的容器中充入
时,向容积不变的容器中充入 和
和 进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在
进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在 时间段内,容器中压强增大的主要原因是
时间段内,容器中压强增大的主要原因是___________ 。

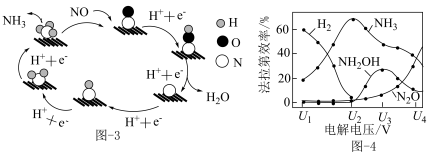
(3)催化电解 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(
,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率( )随电解电压的变化如图-4所示。已知
)随电解电压的变化如图-4所示。已知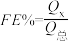 ,
,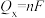 ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;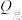 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为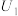 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
②当电解电压为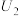 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为___________ 。
③电解电压大于 后,随着电解电压的不断增大,
后,随着电解电压的不断增大, 的法拉第效率迅速增大,可能原因是
的法拉第效率迅速增大,可能原因是___________ (吸附在催化剂上的物种加“*”表示,如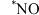 、
、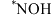 等)。
等)。
 、
、 等)的处理和资源化利用具有重要意义。
等)的处理和资源化利用具有重要意义。(1)
 的处理。研究证明:
的处理。研究证明: 能提高
能提高 的分解速率,
的分解速率, 参与了第Ⅱ步、第Ⅲ步反应。反应历程(
参与了第Ⅱ步、第Ⅲ步反应。反应历程( 为反应活化能):
为反应活化能):第Ⅰ步:

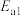
第Ⅱ步:……

第Ⅲ步:
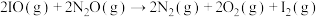
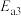
①第Ⅱ步发生反应的方程式为
②总反应的反应速率取决于第Ⅱ步,则

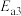 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 的应用。
的应用。 分解
分解 制取
制取 和
和 的原理如下:
的原理如下:反应Ⅰ:


反应Ⅱ:
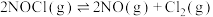

反应的
 (
( 值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
①
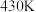 时,反应
时,反应 的
的 为
为②
 时,向容积不变的容器中充入
时,向容积不变的容器中充入 和
和 进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在
进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在 时间段内,容器中压强增大的主要原因是
时间段内,容器中压强增大的主要原因是
(3)催化电解
 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(
,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率( )随电解电压的变化如图-4所示。已知
)随电解电压的变化如图-4所示。已知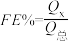 ,
,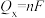 ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;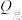 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为
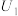 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为②当电解电压为
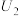 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为③电解电压大于
 后,随着电解电压的不断增大,
后,随着电解电压的不断增大, 的法拉第效率迅速增大,可能原因是
的法拉第效率迅速增大,可能原因是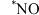 、
、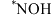 等)。
等)。
您最近一年使用:0次
名校
解题方法
2 . 下列实验操作、现象和所得到的结论均正确的是
| 选项 | 实验内容 | 实验结论 |
| A | 取两支试管,分别加入4mL0.01mol·L-1KMnO4酸性溶液,然后向一支试管中加入0.01mol·L-1H2C2O4溶液2mL,向另一支试管中加入0.01mol·L-1H2C2O4溶液4mL,第一支试管中溶液褪色时间长 | H2C2O4浓度越大,反应速率越快 |
| B | 室温下,用pH试纸分别测定浓度为0.1mol·L-1HClO溶液和0.1mol·L-1HF溶液的pH,前者pH大于后者 | HclO的酸性小于pH |
| C | 检验FeCl2溶液中是否含有Fe2+时,将溶液滴入酸性KMnO4溶液,溶液紫红色褪去 | 不能证明溶液中含有Fe2+ |
| D | 取两支试管,分别加入等体积等浓度的双氧水,然后试管①中加入0.01mol·L-1FeCl3溶液2mL,向试管②中加入0.01mol·L-1CuCl2溶液2mL,试管①中产生气泡快 | 加入FeCl3时,双氧水分解反应的活化能较大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-01-01更新
|
364次组卷
|
8卷引用:2019年湖南省郴州市高三第一次教学质量监测化学试题
名校
解题方法
3 . 催化还原 是实现“碳中和”的重要途径之一、研究表明,在催化剂作用下,
是实现“碳中和”的重要途径之一、研究表明,在催化剂作用下, 和
和 发生反应:
发生反应:
I.

Ⅱ.

(1)已知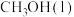 和
和 的燃烧热分别为
的燃烧热分别为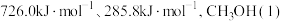 和
和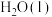 的汽化热分别为
的汽化热分别为 。则
。则
___________  。
。
(2)下列关于反应I和反应Ⅱ的说法错误的是___________ (填标号)。
A.增大 与
与 的投料比有利于提高
的投料比有利于提高 的转化率
的转化率
B.若 的浓度保持不变,则说明反应体系已达平衡状态
的浓度保持不变,则说明反应体系已达平衡状态
C.体系达到平衡后,若升高温度,两个反应重新建立平衡的时间相同
D.体系达到平衡后,若压缩体积,则反应I平衡正向移动,反应Ⅱ平衡不移动
E.及时将 液化分离,有利于提高反应I的正反应速率
液化分离,有利于提高反应I的正反应速率
(3)一般认为反应I通过如下步骤实现:
第一步:
 (慢)
(慢)
第二步:
 (快)
(快)
下列示意图中能体现上述反应能量变化的是___________(填标号)。
(4)研究发现 表面脱除
表面脱除 原子形成的
原子形成的 (氧空穴)决定了
(氧空穴)决定了 的催化效果,氧空穴越多,催化效果越好,
的催化效果,氧空穴越多,催化效果越好, 催化
催化 合成甲醇的机理如图。已知增大气体流速可带走多余的
合成甲醇的机理如图。已知增大气体流速可带走多余的 ,从而提高
,从而提高 的选择性,请结合催化机理解释其原因
的选择性,请结合催化机理解释其原因___________ 。

(5)一定温度下,向 恒容的密闭容器中充入
恒容的密闭容器中充入 和
和 。在催化剂作用下发生反应I、II,容器内气体的压强随反应时间的变化如表所示。
。在催化剂作用下发生反应I、II,容器内气体的压强随反应时间的变化如表所示。
平衡时测得 在体系中的体积分数为
在体系中的体积分数为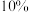 。则0~20min内平均反应速率
。则0~20min内平均反应速率
___________  ;该条件下,
;该条件下, 的选择性(甲醇的物质的量占消耗的
的选择性(甲醇的物质的量占消耗的 的物质的量的百分比)为
的物质的量的百分比)为___________  (结果保留三位有效数字);该温度下反应I的平衡常数
(结果保留三位有效数字);该温度下反应I的平衡常数
___________  (
( 为以平衡分压代替平衡浓度表示的平衡常数,列出计算式即可)。
为以平衡分压代替平衡浓度表示的平衡常数,列出计算式即可)。
 是实现“碳中和”的重要途径之一、研究表明,在催化剂作用下,
是实现“碳中和”的重要途径之一、研究表明,在催化剂作用下, 和
和 发生反应:
发生反应:I.


Ⅱ.


(1)已知
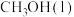 和
和 的燃烧热分别为
的燃烧热分别为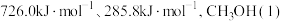 和
和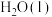 的汽化热分别为
的汽化热分别为 。则
。则
 。
。(2)下列关于反应I和反应Ⅱ的说法错误的是
A.增大
 与
与 的投料比有利于提高
的投料比有利于提高 的转化率
的转化率B.若
 的浓度保持不变,则说明反应体系已达平衡状态
的浓度保持不变,则说明反应体系已达平衡状态C.体系达到平衡后,若升高温度,两个反应重新建立平衡的时间相同
D.体系达到平衡后,若压缩体积,则反应I平衡正向移动,反应Ⅱ平衡不移动
E.及时将
 液化分离,有利于提高反应I的正反应速率
液化分离,有利于提高反应I的正反应速率(3)一般认为反应I通过如下步骤实现:
第一步:

 (慢)
(慢)第二步:

 (快)
(快)下列示意图中能体现上述反应能量变化的是___________(填标号)。
A. | B. | C. | D.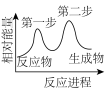 |
(4)研究发现
 表面脱除
表面脱除 原子形成的
原子形成的 (氧空穴)决定了
(氧空穴)决定了 的催化效果,氧空穴越多,催化效果越好,
的催化效果,氧空穴越多,催化效果越好, 催化
催化 合成甲醇的机理如图。已知增大气体流速可带走多余的
合成甲醇的机理如图。已知增大气体流速可带走多余的 ,从而提高
,从而提高 的选择性,请结合催化机理解释其原因
的选择性,请结合催化机理解释其原因
(5)一定温度下,向
 恒容的密闭容器中充入
恒容的密闭容器中充入 和
和 。在催化剂作用下发生反应I、II,容器内气体的压强随反应时间的变化如表所示。
。在催化剂作用下发生反应I、II,容器内气体的压强随反应时间的变化如表所示。 | 0 | 5 | 10 | 15 | 20 | 25 |
 | 6.0 | 5.55 | 5.2 | 4.95 | 4.8 | 4.8 |
 在体系中的体积分数为
在体系中的体积分数为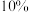 。则0~20min内平均反应速率
。则0~20min内平均反应速率
 ;该条件下,
;该条件下, 的选择性(甲醇的物质的量占消耗的
的选择性(甲醇的物质的量占消耗的 的物质的量的百分比)为
的物质的量的百分比)为 (结果保留三位有效数字);该温度下反应I的平衡常数
(结果保留三位有效数字);该温度下反应I的平衡常数
 (
( 为以平衡分压代替平衡浓度表示的平衡常数,列出计算式即可)。
为以平衡分压代替平衡浓度表示的平衡常数,列出计算式即可)。
您最近一年使用:0次
名校
4 . 一定温度下,向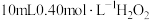 溶液中加入适量
溶液中加入适量 溶液,不同时刻测得生成
溶液,不同时刻测得生成 的体积(已折算为标准状况)如下表所示.资料显示,反应分两步进行:①
的体积(已折算为标准状况)如下表所示.资料显示,反应分两步进行:① ,②
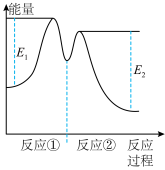
,② ,反应过程中能量变化如图所示.下列说法不正确的是
,反应过程中能量变化如图所示.下列说法不正确的是
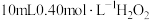 溶液中加入适量
溶液中加入适量 溶液,不同时刻测得生成
溶液,不同时刻测得生成 的体积(已折算为标准状况)如下表所示.资料显示,反应分两步进行:①
的体积(已折算为标准状况)如下表所示.资料显示,反应分两步进行:① ,②
,② ,反应过程中能量变化如图所示.下列说法不正确的是
,反应过程中能量变化如图所示.下列说法不正确的是
| 0 | 2 | 4 | 6 |
| 0 | 9.9 | 17.2 | 22.4 |

A.0~6min的平均反应速率: |
B. 的作用是增大过氧化氢的分解速率 的作用是增大过氧化氢的分解速率 |
| C.反应①是吸热反应、反应②是放热反应 |
D.反应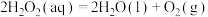 的 的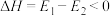 |
您最近一年使用:0次
2024-01-10更新
|
172次组卷
|
2卷引用:北京市第一六一中学2023-2024学年高三下学期一模适应性训练化学试题
解题方法
5 . 我国科学家利用两种不同的纳米催化剂(Co3O4/Pt,N-Co3O4/Pt)在室温水汽条件下实现高效CO催化氧化(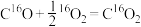 ),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
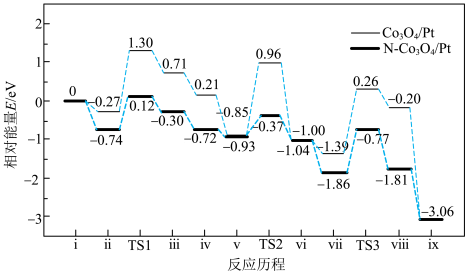
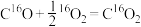 ),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
| A.效果较好的催化剂是N-Co3O4/Pt |
B.若利用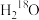 进行同位素标记实验,检测到以上反应中有 进行同位素标记实验,检测到以上反应中有 和 和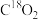 生成,说明O-H键断裂 生成,说明O-H键断裂 |
C.反应: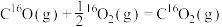 的 的 |
| D.若ⅱ表示H2O被吸附在催化剂表面,则Co3O4/Pt更容易吸附H2O |
您最近一年使用:0次
名校
解题方法
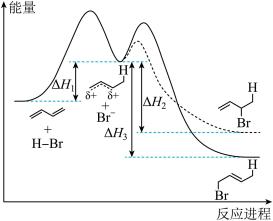
6 . 已知1,3-丁二烯与HBr加成的能量-反应进程图如图所示(图中 、
、 、
、 表示各步正向反应的焓变)。下列说法
表示各步正向反应的焓变)。下列说法不正确 的是
 、
、 、
、 表示各步正向反应的焓变)。下列说法
表示各步正向反应的焓变)。下列说法
| A.选择相对较低的温度,并在较短时间及时分离可获得较高产率的1,2-加成产物 |
| B.增大溴离子浓度可以提高整体反应的速率 |
| C.根据该反应可推测,1,3,5-己三烯与HBr在高温下反应的主要产物应为CH3CH=CHCH=CHCH2Br |
D.1,3-丁二烯与HBr发生1,2-加成的反应热为 ,发生1,4-加成的反应热为 ,发生1,4-加成的反应热为 |
您最近一年使用:0次
解题方法
7 . 2023年10月7日,《临汾日报》发表题为《全省首家氢能源公共自行车,落地曲沃》的报道。氢能源是清洁的二次能源,水煤气的变换反应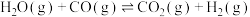 是一种重要的制氢手段,金基二元合金团簇
是一种重要的制氢手段,金基二元合金团簇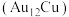 催化水煤气变换反应发生的氧化还原机理有A和B两种途径(*表示物质吸附在催化剂上)。
催化水煤气变换反应发生的氧化还原机理有A和B两种途径(*表示物质吸附在催化剂上)。
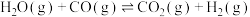 是一种重要的制氢手段,金基二元合金团簇
是一种重要的制氢手段,金基二元合金团簇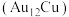 催化水煤气变换反应发生的氧化还原机理有A和B两种途径(*表示物质吸附在催化剂上)。
催化水煤气变换反应发生的氧化还原机理有A和B两种途径(*表示物质吸附在催化剂上)。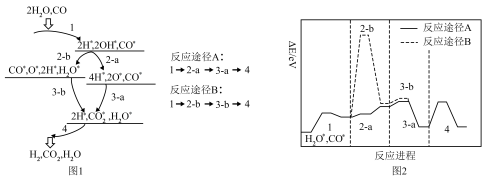
A.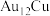 不参与制氢的化学反应 不参与制氢的化学反应 |
B.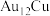 可提高 可提高 的平衡产率 的平衡产率 |
| C.水煤气的变换反应历程中同时存在极性键、非极性键的断裂和形成 |
| D.根据图2,反应途径A更有利于水煤气的变换反应 |
您最近一年使用:0次
2024·广东·模拟预测
名校
解题方法
8 . 直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为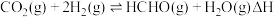 。转化步骤如下图所示:
。转化步骤如下图所示:

(1)甲醇与甲醛中∠OCH键角较大的是_______ ,导致键角不同的原因是_______ 。
(2)已知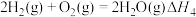 ,则总反应的
,则总反应的
_______ (用图1中焓变以及 表示)。
表示)。
(3)T℃,在容积为2L的恒容密闭容器中充入1molCO2和一定量H2,只发生可逆反应①。若起始时容器内气体压强为1.2kPa,达到平衡时,CH3OH(g)的分压与起始投料比[n(H2)/n(CO2)]的变化关系如下图2所示
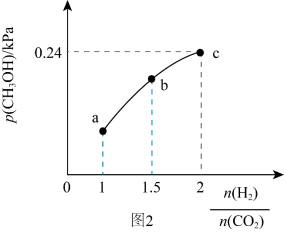
(i)若5min时到达c点,则0~5min时的平均反应速率v(H2)=_______  ;
;
(ii)Kp=_______ (写计算表达式);
(4)在恒温恒容条件下只发生反应②。关于该步骤的下列说法错误的是_______。
(5)已知Arrhenius公式: (Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是
(Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是_______ (填编号①、②);研究表明,加入某极性介质有助于加快整个反应的合成速率,原因可能是_______ 。

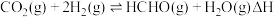 。转化步骤如下图所示:
。转化步骤如下图所示:
(1)甲醇与甲醛中∠OCH键角较大的是
(2)已知
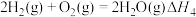 ,则总反应的
,则总反应的
 表示)。
表示)。(3)T℃,在容积为2L的恒容密闭容器中充入1molCO2和一定量H2,只发生可逆反应①。若起始时容器内气体压强为1.2kPa,达到平衡时,CH3OH(g)的分压与起始投料比[n(H2)/n(CO2)]的变化关系如下图2所示

(i)若5min时到达c点,则0~5min时的平均反应速率v(H2)=
 ;
;(ii)Kp=
(4)在恒温恒容条件下只发生反应②。关于该步骤的下列说法错误的是_______。
A.若反应②正向为自发反应,需满足 |
| B.若气体的平均相对分子质量保持不变,说明反应②体系已经达到平衡 |
| C.增大O2的浓度,HCHO(g)的平衡物质的量分数一定增大 |
| D.反应②体系始终存在v生成(H2O2)=v消耗(CH3OH) |
 (Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是
(Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是
您最近一年使用:0次
名校
解题方法
9 . 已知阿仑尼乌斯公式是反应速率常数随温度变化关系的经验公式,可写作 (k为反应速率常数,
(k为反应速率常数, 为反应活化能,R和C为大于0的常数),为探究m、n两种催化剂对某反应的催化效能,进行了实验探究,依据实验数据获得曲线如图所示。下列说法错误的是
为反应活化能,R和C为大于0的常数),为探究m、n两种催化剂对某反应的催化效能,进行了实验探究,依据实验数据获得曲线如图所示。下列说法错误的是
 (k为反应速率常数,
(k为反应速率常数, 为反应活化能,R和C为大于0的常数),为探究m、n两种催化剂对某反应的催化效能,进行了实验探究,依据实验数据获得曲线如图所示。下列说法错误的是
为反应活化能,R和C为大于0的常数),为探究m、n两种催化剂对某反应的催化效能,进行了实验探究,依据实验数据获得曲线如图所示。下列说法错误的是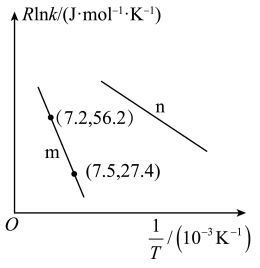
A.在m催化剂作用下,该反应的活化能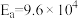 J⋅mol-1 J⋅mol-1 |
| B.对该反应催化效能较高的催化剂是m |
| C.不改变其他条件,只升高温度,反应的活化能不变 |
| D.无法根据该图像判断升高温度时平衡移动的方向 |
您最近一年使用:0次
2023-06-19更新
|
973次组卷
|
3卷引用:河北省沧州市盐山中学2023届高三三模考试化学试题
名校
解题方法
10 . 甲苯与乙酰氯(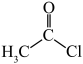 )在无水
)在无水 催化下发生反应,其反应机理如图所示。乙酰氯经过步骤I得到的中间体可能存在P、O两种形式,且其缺电子的结构与甲苯的π电子云作用生成过渡态π-络合物N,经过步骤Ⅱ得到σ-络合物M。下列说法错误的是
催化下发生反应,其反应机理如图所示。乙酰氯经过步骤I得到的中间体可能存在P、O两种形式,且其缺电子的结构与甲苯的π电子云作用生成过渡态π-络合物N,经过步骤Ⅱ得到σ-络合物M。下列说法错误的是
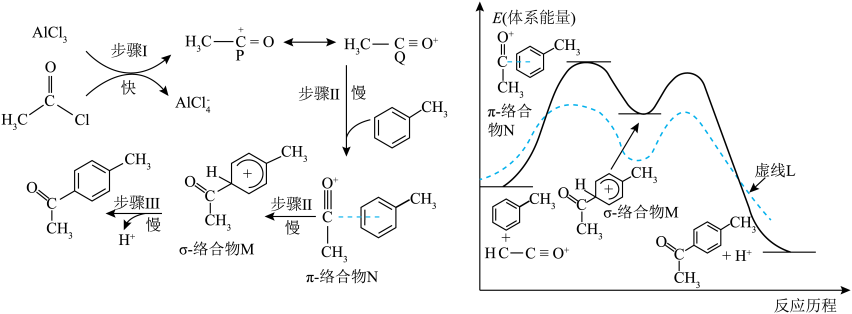
| A.中间体P、Q中不饱和碳原子的杂化方式相同 |
| B.该反应的决速步是步骤Ⅱ |
C.甲苯与乙酰氯反应过程中有反应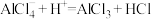 发生 发生 |
D.虚线L可表示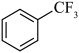 与 与 反应过程中的能量变化 反应过程中的能量变化 |
您最近一年使用:0次
2023-06-01更新
|
317次组卷
|
4卷引用:山东省日照市2023届高三下学期三模化学试题




