1 . 氟利昂是饱和碳氢化合物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以二氯二氟甲烷为例,二氯二氟甲烷可由四氯化碳与氟化氢在催化剂存在下、控制回流冷凝温度为﹣5℃时得到):
①CF2Cl2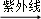 CF2Cl+Cl
CF2Cl+Cl
②Cl+O3→ClO+O2
③ClO+ClO→ClOOCl(过氧化氯)
④ClOOCl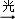 2Cl+O2
2Cl+O2
下列说法中不正确的是
①CF2Cl2
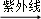 CF2Cl+Cl
CF2Cl+Cl②Cl+O3→ClO+O2
③ClO+ClO→ClOOCl(过氧化氯)
④ClOOCl
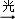 2Cl+O2
2Cl+O2下列说法中不正确的是
| A.紫外线使CF2Cl2分解产生的是臭氧生成氧气的催化剂 |
| B.反应③中的氯子与反应④中生成的氯原子化学性质相同 |
| C.ClOOCl分子中各原子最外层均达到8电子稳定结构 |
| D.气态氢化物的稳定性:HF>H2O>HCl |
您最近一年使用:0次
名校
2 . 室温下进行的下列实验,不能达到预期目的是
| 实验内容 | 实验目的 | |
| A | 向同体积同浓度H2O2溶液中,分别加入1 mol/L的CuCl2、FeCl3溶液 | 比较Cu2+、Fe3+对H2O2分解速率的影响 |
| B | 向Mg(OH)2浊液中滴加少量0.1 mol/L FeCl3溶液 | 比较Mg(OH)2和Fe(OH)3的溶解度 |
| C | 将SO2通入酸性高锰酸钾溶液中 | 探究SO2的还原性 |
| D | 测定相同浓度的NaClO溶液,CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-11-27更新
|
224次组卷
|
2卷引用:河北省唐山一中2019届高三上学期期中考试化学试题
名校
3 . 合成氨是工业上的重要反应:N2(g)+3H2(g) 2NH3(g),下列说法
2NH3(g),下列说法不正确 的是
 2NH3(g),下列说法
2NH3(g),下列说法| A.反应达平衡状态后,各物质浓度不变,反应停止 |
| B.反应达平衡状态后,单位时间内生成1mol N2的同时消耗3mol H2 |
| C.在上述条件下,N2不可能100%转化为NH3 |
| D.使用催化剂是为了加快反应速率,提高生产效率 |
您最近一年使用:0次
2018-06-15更新
|
387次组卷
|
6卷引用:河北省石家庄市正定中学2022-2023学年高三上学期12月月考化学试题
名校
4 . H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确的是
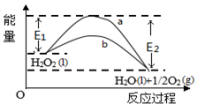

| A.有MnO2 条件下的反应曲线是a曲线 |
| B.该反应能量变化类型与CaCO3分解反应相同 |
| C.加催化剂后,正反应速率加快,逆反应速率减小 |
| D.b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH=( E1 - E2 )kJ•mol-1 |
您最近一年使用:0次
2018-06-03更新
|
341次组卷
|
9卷引用:河北省衡水市安平县安平中学2019届高三上学期期中考试化学试题
河北省衡水市安平县安平中学2019届高三上学期期中考试化学试题浙江省余姚中学2018届高三选考科目模拟卷(一)化学(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化(已下线)高考母题题源05 化学反应与能量【全国百强校】浙江省台州中学2019届高三上学期第一次统练化学试题(已下线)【新东方】高中化学5013四川省成都石室中学2021届高三上学期开学考试化学试题云南省瑞丽市第一民族中学2021-2022学年高一上学期期末考试 化学试题云南省瑞丽市第一民族中学2021-2022学年高二上学期期末考试化学试题
11-12高二·河南安阳·阶段练习
名校
5 . 可逆反应mA(g)+nB(g)  pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
 pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图: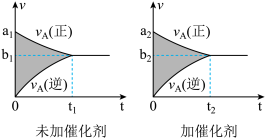
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
| A.②④⑤⑦ | B.①④⑥⑧ | C.②③⑤⑧ | D.①③⑥⑦ |
您最近一年使用:0次
2019-10-15更新
|
206次组卷
|
13卷引用:【全国百强校】河北省武邑中学2019届高三上学期第一次调研考试化学试题
【全国百强校】河北省武邑中学2019届高三上学期第一次调研考试化学试题【全国百强校】海南省海南中学2018届高三第五次月考化学试题黑龙江省哈尔滨市第一中学2021届高三上学期期中考试化学试题(已下线)2012-2013学年河南省安阳一中高二第二次阶段考试化学试卷(已下线)2013-2014学年江苏省无锡江阴市高二下学期期中考试化学试卷2015-2016学年湖南省衡阳八中高二上第二次月考化学试卷黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题湖北省襄阳市第四中学2017-2018学年高二10月月考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题辽宁省普兰店市第一中学2018-2019学年高二(理)上学期期中考试化学试题山西省运城市河津中学2019-2020学年高二9月月考化学试题吉林省白山市抚松县第六中学2019-2020学年高二上学期期中考试化学试题湖北省孝感市普通高中协作体2022-2023学年高二上学期期中联合考试化学试题
6 . 某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,下列有关叙述正确的是
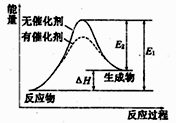

| A.该反应为放热反应 | B.催化剂能降低该反应的ΔH |
| C.E2可表示该反应逆反应的活化能 | D.ΔH=E2-E1 |
您最近一年使用:0次
名校
7 . 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验I】试剂:酸化的0.5mol·L-1 FeSO4溶液(pH =0.2),5%H2O2溶液(pH=5)。
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________________________ 。
(2)产生气泡的原因是______________________ 。
【实验Ⅱ】试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4 mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是_______________ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是____________________ 。
②实验验证假设ⅱ: 取__________ 溶液,加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是_________________ 。
【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是___________________ 。
(7)由实验I、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与______________ (至少写两点)有关。
【实验I】试剂:酸化的0.5mol·L-1 FeSO4溶液(pH =0.2),5%H2O2溶液(pH=5)。
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5%H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH = 0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(2)产生气泡的原因是
【实验Ⅱ】试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL5%H2O2溶液于试管中, 加入5滴上述FeSO4溶液, | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH =1.4 |
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是
②实验验证假设ⅱ: 取
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是
【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是
(7)由实验I、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与
您最近一年使用:0次
2017-06-05更新
|
724次组卷
|
6卷引用:河北省武邑中学2018届高三上学期第三次调研考试化学试题
名校
8 . 分别进行下列操作,由现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
A | 向某一溶液中滴加Ba(NO3)2和HNO3混合溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 向盛有2mL0.1mol/LAgNO3溶液的试管中滴加1mL0.1mol/ LNaCl溶液,再向其中滴加4~5滴0.1mol/LKI溶液 | 先有白色沉淀成,后又产生黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |
C | 室温下,取相同大小、形状和质量的Cu粒分别投入0.1mol/L的稀硝酸和10.0mol/L的浓硝酸中 | Cu粒与浓硝酸反应比与稀硝酸反应剧烈 | 探究浓度对化学反应速率的影响 |
D | 向某一溶液中滴加稀盐酸,将生成的气体通入澄清石灰水中 | 澄清石灰水变浑浊 | 生成的气体可能是SO2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-05-24更新
|
825次组卷
|
2卷引用:河北省石家庄市第二中学2017届高三5月联考理科综合化学试题
名校
9 . 在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
 2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是| A.平衡前,随着反应的进行,容器内压强变小 |
| B.平衡时,其他条件不变,分离出H2O(g),逆反应速率减小 |
| C.平衡时,其他条件不变,升高温度平衡常数增大 |
| D.其他条件不变,使用不同催化剂,HCl(g)的转化率不变 |
您最近一年使用:0次
2017-03-11更新
|
373次组卷
|
6卷引用:河北省隆化县存瑞中学2020届高三上学期第一次质检化学试题
名校
解题方法
10 . 下列有关物质的性质或应用正确的是
| A.单质硅用于制造芯片和光导纤维 |
| B.浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D.30%的H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
您最近一年使用:0次
2016-12-09更新
|
1537次组卷
|
5卷引用:河北省张家口市崇礼区第一中学2021届高三上学期期中考试化学试题
河北省张家口市崇礼区第一中学2021届高三上学期期中考试化学试题 黑龙江省大庆中学2018届高三上学期开学考试化学试题(已下线)2018年12月14日 《每日一题》人教必修1-常见非金属及其化合物的用途(已下线)2019年12月13日 《每日一题》化学人教版(必修1)——常见非金属及其化合物的用途安徽省肥东县高级中学2020-2021学年高二上学期第二次月考化学试题



