解题方法
1 . 下列实验装置能达到相应实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 验证牺牲阳极法保护铁 | 制备并收集氨气 | 验证 | 关闭a、打开b,可检查装置的气密性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 下列操作或装置正确并能达到实验目的的是
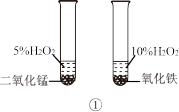






| A.图①用于比较二氧化锰和氧化铁的催化效果 |
| B.图②用此装置可制CaCO3沉淀 |
| C.图③用于检验铜与浓硫酸反应后的混合液中是否含有Cu2+ |
| D.图④用于制备Fe(OH)2沉淀 |
您最近一年使用:0次
3 . 用下列仪器或装置(图中夹持略)进行相应实验,能达到实验目的的是
| A | B | C | D |
 | 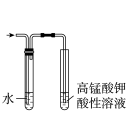 | 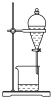 |  |
蒸发结晶制备 晶体 晶体 | 检验溴乙烷消去产物 | 分离苯和溴苯 | 探究不同催化剂 对  分解速率的影响 分解速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-18更新
|
659次组卷
|
6卷引用:复旦大学附属中学2022届高三下学期 教学质量检测(二模)化学等级试卷
17-18高一下·湖北·期中
名校
解题方法
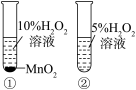
4 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是其它条件相同时,探究______ 条件对H2O2分解速率的影响。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是____________________________________ 。
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是____ (填字母代号)。

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
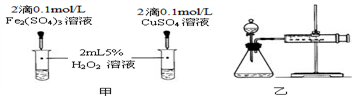
①定性分析:如图甲可通过观察________________________ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是______________________ 。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是________________ ,所需仪器为_______ 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________ 思想方法的应用。
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增多。 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液。 | 两支试管中均未明显见到有气泡产生。 |
(1)实验①的目的是其它条件相同时,探究
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(5)通过对上述实验过程的分析,在实验设计时,要考虑
您最近一年使用:0次
2018-04-25更新
|
652次组卷
|
4卷引用:《2018-2019学年同步单元双基双测AB卷》第二单元 化学反应速率与化学平衡单元测试A卷
(已下线)《2018-2019学年同步单元双基双测AB卷》第二单元 化学反应速率与化学平衡单元测试A卷河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学(实验班)试题湖北省沙市中学2017-2018学年高一下学期期中考试化学试题江苏省启东中学2017-2018学年高一下学期期中考试化学试题
名校
解题方法
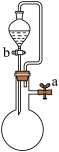
5 . 亚硝酰硫酸(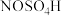 )在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
)在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
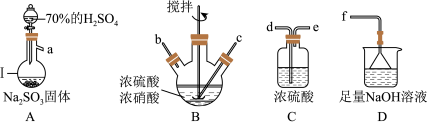
已知:i.亚硝酰硫酸遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解;
 .实验室制备亚硝酰硫酸的原理为
.实验室制备亚硝酰硫酸的原理为 ,
, 。
。
(1)仪器Ⅰ的名称为___________ ,按照气流从左到右的顺序,上述仪器的连接顺序为___________ (填仪器接口的字母,字母之间用“→”连接,部分仪器可以重复使用),C装置的作用为___________ 。
(2)反应需控制温度在25~40℃,采用的加热措施为___________ ,开始时反应缓慢,但某时刻反应速率明显加快,其原因可能是___________ 。
(3)测定亚硝酰硫酸的纯度:
步骤①:准确称取 产品,在特定条件下配制成
产品,在特定条件下配制成 溶液。
溶液。
步骤②:取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 未知浓度
未知浓度 溶液(过量)和
溶液(过量)和 的
的 溶液,摇匀,发生反应
溶液,摇匀,发生反应
步骤③:向该溶液中滴加 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液的体积为
溶液的体积为 。
。
步骤④:把亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗 溶液的体积为
溶液的体积为 。
。
滴定终点时的现象为___________ ,亚硝酰硫酸的纯度为___________ (精确到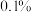 )。
)。
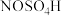 )在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
)在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
已知:i.亚硝酰硫酸遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解;
 .实验室制备亚硝酰硫酸的原理为
.实验室制备亚硝酰硫酸的原理为 ,
,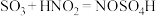 。
。(1)仪器Ⅰ的名称为
(2)反应需控制温度在25~40℃,采用的加热措施为
(3)测定亚硝酰硫酸的纯度:
步骤①:准确称取
 产品,在特定条件下配制成
产品,在特定条件下配制成 溶液。
溶液。步骤②:取
 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 未知浓度
未知浓度 溶液(过量)和
溶液(过量)和 的
的 溶液,摇匀,发生反应
溶液,摇匀,发生反应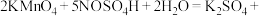
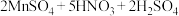
步骤③:向该溶液中滴加
 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液的体积为
溶液的体积为 。
。步骤④:把亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗
 溶液的体积为
溶液的体积为 。
。滴定终点时的现象为
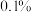 )。
)。
您最近一年使用:0次
2023-05-19更新
|
455次组卷
|
6卷引用:山西省忻州市2023届高三下学期二轮复习联考(三)理综化学试题
山西省忻州市2023届高三下学期二轮复习联考(三)理综化学试题河南省开封市2022-2023学年高三下学期5月月考理综化学试题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)实验探究题山东省聊城市百师联盟2023届高三下学期(二轮复习联考)模拟预测(三)化学试题江西省丰城中学、新建二中2022-2023学年高二下学期期末联考化学试题
23-24高二·全国·假期作业
6 . 某学生为探究锌与稀盐酸反应的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为25℃、35℃。(已知Zn2+对该反应速率无影响)
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在30~40s范围内盐酸的平均反应速率ν(HCl)=___________ (忽略溶液体积变化);
②反应速率最大的时间段(如0~10s)为___________ ,可能原因是___________ ;
③反应速率后段明显下降的主要影响因素是___________ 。
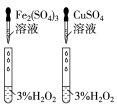
(3)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。___________ 现象,比较得出Fe3+和Cu2+对H2O2分解的催化效果结论;
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________ 。
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
| 编号 | t/℃ | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | I.实验①和②探究盐酸浓度对该反应速率的影响; Ⅱ.实验 Ⅲ.实验 |
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积/mL | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(如0~10s)为
③反应速率后段明显下降的主要影响因素是
(3)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。
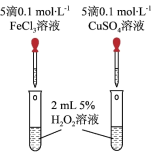
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
您最近一年使用:0次
2023·全国·模拟预测
名校
解题方法
7 . 下列实验设计及现象、结论合理的是
| 选项 | 实验目的 | 实验设计及现象 | 结论 |
| A | 探究 是否具有还原性 是否具有还原性 | 向一定浓度的 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 |  具有还原性 具有还原性 |
| B | 检验 气体中是否混有 气体中是否混有 | 将气体依次通过饱和 溶液和澄清石灰水,澄清石灰水变浑浊 溶液和澄清石灰水,澄清石灰水变浑浊 |  气体中混有 气体中混有 |
| C | 探究HA是否是弱电解质 | 测某温度下一定浓度NaA溶液的pH,pH>7 | HA是弱电解质 |
| D | 探究不同催化剂的催化效率 | 两支试管中分别盛相同温度、相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液与 溶液与 溶液,滴加FeCl3溶液得试管中产生气体更快 溶液,滴加FeCl3溶液得试管中产生气体更快 |  对 对 分解的催化效率更高 分解的催化效率更高 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-08更新
|
1100次组卷
|
4卷引用:全国卷(老教材)理综化学预测卷
(已下线)全国卷(老教材)理综化学预测卷(已下线)热点08 表格型实验方案的设计与评价2023届江西省南昌市第十九中学高三下学期第三次模拟考试理科综合试卷-高中化学广西北海市2024届高三一模考试化学试题
名校
解题方法
8 . 下列实验操作可以达到实验目的的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将1mL  溶液与1mL 溶液与1mL KI溶液混合,充分反应后分为两份,一份加2滴KSCN,另一份加2滴淀粉试液,观察现象 KI溶液混合,充分反应后分为两份,一份加2滴KSCN,另一份加2滴淀粉试液,观察现象 | 证明KI与 能反应且具有可逆性 能反应且具有可逆性 |
| B | 向两支盛有2mL5% 溶液的试管中分别加入 溶液的试管中分别加入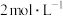 的 的 溶液和 溶液和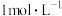 的 的 溶液,比较产生气泡速率 溶液,比较产生气泡速率 |  催化 催化 分解效果优于 分解效果优于 |
| C | 向饱和 溶液中通入某无色无味气体X,观察是否有沉淀生成 溶液中通入某无色无味气体X,观察是否有沉淀生成 | 确定X是否为 |
| D | 用pH计分别测定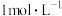 和 和 的 的 溶液的pH,记录并比较pH变化 溶液的pH,记录并比较pH变化 | 随着溶液中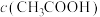 减小, 减小, 的电离程度增大 的电离程度增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
22-23高一下·山东泰安·期中
9 . 某学生为探究锌与稀盐酸反应的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为25℃、35℃。(已知Zn2+对该反应的反应速率无影响)
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在30~40s范围内盐酸的平均反应速率ν(HCl)=_______ (忽略溶液体积变化);
②反应速率最大的时间段(如0~10s)为_______ ,可能原因是_______ ;
③反应速率后段明显下降的主要影响因素是_______ 。
(3)测量氢气体积时,在不影响产生H2气体总量的情况下,往往在盐酸中分别加入相同体积的下列溶液以减慢反应速率,你认为可行的是_______(填序号)。
(4)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。
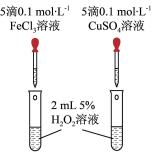
①如图可通过观察_______ 现象,比较得出Fe3+和Cu2+对H2O2分解的催化效果结论;
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
| 编号 | t/℃ | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | I.实验①和②探究盐酸浓度对该反应速率的影响; II.实验 III.实验 |
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积/mL | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(如0~10s)为
③反应速率后段明显下降的主要影响因素是
(3)测量氢气体积时,在不影响产生H2气体总量的情况下,往往在盐酸中分别加入相同体积的下列溶液以减慢反应速率,你认为可行的是_______(填序号)。
| A.NaNO3溶液 | B.NaCl溶液 | C.CuSO4溶液 | D.Na2CO3溶液 |

①如图可通过观察
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
您最近一年使用:0次
名校
解题方法
10 . 某小组探究 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
【实验探究】
实验i:向装有0.5g 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。
(1)写出该反应的化学方程式:_______ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是_______ (用离子反应方程式表示);经检验产生的气体为氧气,产生氧气的原因是_______ 。
(3)对比实验i和iii,为探究氨水对 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
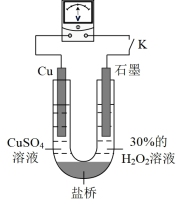
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:_______ 。
②利用该方法也可证明酸性增强可提高 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是_______ 。
(4)总结:物质氧化性和还原性变化的一般规律是_______ 。
(5)应用: 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因_______ 。
 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。【实验探究】
实验i:向装有0.5g
 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。(1)写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
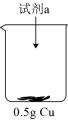 | ii | 20mL30% 与4mL 与4mL5mol/L  混合液 混合液 |  表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| iii | 20mL30% 与4mL 与4mL5mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡, 表面有少量蓝色不溶物 表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究氨水对
 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:
②利用该方法也可证明酸性增强可提高
 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是(4)总结:物质氧化性和还原性变化的一般规律是
(5)应用:
 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因
您最近一年使用:0次
2022-06-03更新
|
539次组卷
|
4卷引用:北京市和平街第一中学2021-2022学年高三下学期保温化学试题
北京市和平街第一中学2021-2022学年高三下学期保温化学试题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)微专题 物质性质综合实验探究北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题


 是
是 分解的催化剂
分解的催化剂

