名校
1 . 氢气既是一种清洁能源,又是重要的化工原料。回答下列问题:
(1)已知:断裂1molH-H、1molO=O、1molH-O键吸收的能量依次为436kJ、498kJ、467kJ,在2H2(g)+O2(g)=2H2O(g)反应中,44.8LH2(标准状况治好完全反应放出的能量为_____ kJ。
(2)实验室用纯净的铝片与稀硫酸反应制取氢气。
①实验过程如图所示,分析判断_____ 段化学反应速率最快(填OE、EF或FG)。
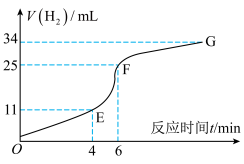
②将铝片投入盛有稀硫酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是_____ 。
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水:③将铝片换成铝粉;④增加硫酸的浓度至18mol/L;⑤_____ ;⑥_____ 。以上方案不合理的有_____ ;请你再补充两种合理方案,填入空白⑤⑥处。
(1)已知:断裂1molH-H、1molO=O、1molH-O键吸收的能量依次为436kJ、498kJ、467kJ,在2H2(g)+O2(g)=2H2O(g)反应中,44.8LH2(标准状况治好完全反应放出的能量为
(2)实验室用纯净的铝片与稀硫酸反应制取氢气。
①实验过程如图所示,分析判断

②将铝片投入盛有稀硫酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水:③将铝片换成铝粉;④增加硫酸的浓度至18mol/L;⑤
您最近一年使用:0次
名校
解题方法
2 . 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/L NaHSO3溶液,所得数据如图所示。
已知:ClO +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
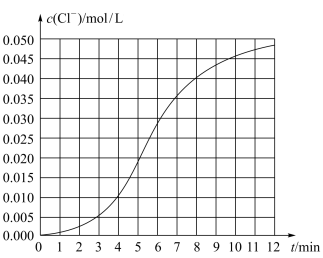
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=____ mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
①补全方案I中的实验操作:____ 。
②方案II中的假设为____ 。
③除I、II、III中的假设外,还可以提出的假设是____ 。
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:____ 。
ii.12min后,化学反应速率变慢的原因是_____ 。
已知:ClO
 +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
| 方案 | 假设 | 实验操作 |
| I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,_____ |
| II | ____ | 取10mL0.1mol/L KClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液 |
| III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1mL水,向烧杯②中加入1mL0.2mol/L盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液 |
②方案II中的假设为
③除I、II、III中的假设外,还可以提出的假设是
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:
ii.12min后,化学反应速率变慢的原因是
您最近一年使用:0次
2022-06-18更新
|
453次组卷
|
12卷引用:河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题
河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)必修第二册RJ第6章第二节 化学反应的速率与限度 课时1人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素河南省洛阳市2020-2021学年高一下学期期中考试化学试题选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素贵州省“三新”改革联盟2021-2022学年高一下学期校联考等级考(四)化学试题北京海淀区八一学校2021-2022学年高一下学期6月月考化学试题2019版鲁科化学必修第二册第2章本章自我评价课后习题2.1.2影响化学反应速率的因素 课后
名校
3 . 根据所学知识,回答下列问题:
(1)下列变化中,属于放热反应的是_______ ,属于吸热反应的是_______ 。(填标号)
①氧化钙与水反应;②石灰石在高温下的分解反应;③酸碱中和反应;④二氧化碳通过炽热的炭发生的反应;⑤食物因氧化而腐败发生的反应;⑥Ba(OH)2·8H2O与NH4Cl的反应;⑦干冰汽化。
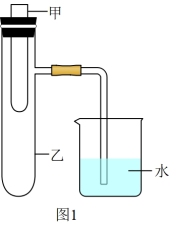
(2)为探究固体M溶于水的热效应,选择图1装置进行实验(在甲中进行)。观察到烧杯里产生气泡,则M溶于水_______ (填“一定”或“可能”)是放热反应,理由是_______ 。
(3)工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图2所示。
CH3OH(g),反应过程中的能量变化情况如图2所示。
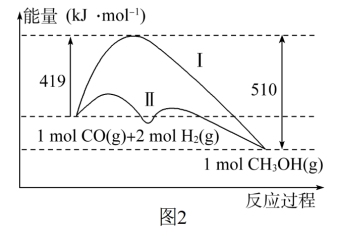
①曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是_______ (填“吸热”或“放热”)反应。当反应生成1.5molCH3OH(g)时,能量变化值是_______ kJ。
②选择适宜的催化剂_______ (填“能”或“不能”)改变该反应的反应热。
(1)下列变化中,属于放热反应的是
①氧化钙与水反应;②石灰石在高温下的分解反应;③酸碱中和反应;④二氧化碳通过炽热的炭发生的反应;⑤食物因氧化而腐败发生的反应;⑥Ba(OH)2·8H2O与NH4Cl的反应;⑦干冰汽化。
(2)为探究固体M溶于水的热效应,选择图1装置进行实验(在甲中进行)。观察到烧杯里产生气泡,则M溶于水

(3)工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g)
 CH3OH(g),反应过程中的能量变化情况如图2所示。
CH3OH(g),反应过程中的能量变化情况如图2所示。
①曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是
②选择适宜的催化剂
您最近一年使用:0次
2022-04-20更新
|
216次组卷
|
3卷引用:河北省保定市2021-2022学年高一下学期第一次月考化学试题
填空题
|
适中(0.65)
|
4 . 回答下列问题:
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:____ 。
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:____ 。
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。
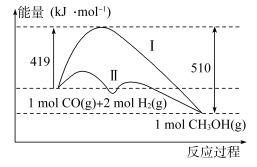
①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是____ kJ。
②选择适宜的催化剂____ (填“能”或“不能”)改变该反应的反应热。
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需____ (填“吸收”或“放出”)能量____ kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是____ 。
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。

①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是
②选择适宜的催化剂
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需
您最近一年使用:0次
5 . 对于反应: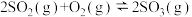 ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
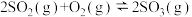 ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。| 编号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大O2的浓度 | |
| ④ | 使用V2O5作催化剂 |
您最近一年使用:0次
2020-04-19更新
|
237次组卷
|
2卷引用:河北省沧州市盐山县盐山中学2019-2020学年高一下学期月考化学试题
名校
6 . Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出上述实验中发生反应的化学方程式:______ 。
(2)实验结果表明,催化剂的催化效果与_____ 有关。
(3)某同学在10 mL H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是_____ 。
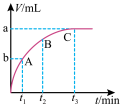
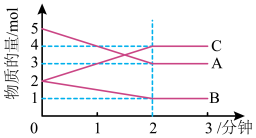
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
(4)该反应的的化学方程式为__________ 。
(5)反应开始至2分钟时,B的平均反应速率为____ 。
(6)能说明该反应已达到平衡状态的是____ 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数______ 。
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:
(2)实验结果表明,催化剂的催化效果与
(3)某同学在10 mL H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
(4)该反应的的化学方程式为
(5)反应开始至2分钟时,B的平均反应速率为
(6)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数

您最近一年使用:0次
2019-12-24更新
|
135次组卷
|
2卷引用:河北省宣化市第一中学2019-2020学年高一11月月考化学试题



