名校
解题方法
1 . 红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g)⇌8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)
请回答下列问题:
(1)请写出上述反应的化学平衡常数表达式:K=_______ 。
(2)此反应的lnK随着 的增大而增大,则反应的ΔH
的增大而增大,则反应的ΔH_______ 0(填“>”或“<”)。
(3)在一容积固定的密闭容器中加入一定量的反应物发生上述反应。该反应的逆反应速率与时间的关系如图所示:
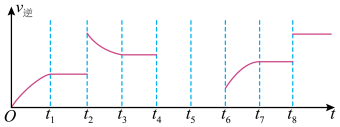
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,试判断t8时改变的条件可能是:_______ 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。_________
(4)Cr2O3为重要铬系产品,我国科学家采用Cr2O3(SG)和H-SAPO-34复合催化剂极大提高短链烯烃选择性。CO2和H2在催化剂Cr2O3(SG)表面转化为甲醇的各步骤所需要克服的能垒及甲醇在H-SAPO-34作用下产生乙烯、丙烯示意图如图。
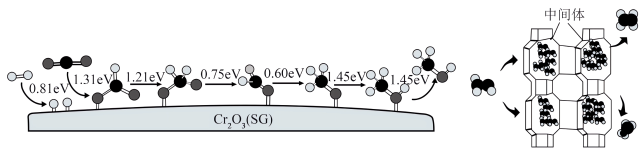
①吸附态用*表示,CO2→甲氧基(H3CO∗)过程中,_______ 的生成是决速步骤(填化学式)。
②H-SAPO-34具有氧八元环构成的笼状结构(直径0.94nm),笼口为小的八环孔(直径0.38nm)。从结构角度推测、短链烯烃选择性提高的原因是_______ 。
请回答下列问题:
(1)请写出上述反应的化学平衡常数表达式:K=
(2)此反应的lnK随着
 的增大而增大,则反应的ΔH
的增大而增大,则反应的ΔH(3)在一容积固定的密闭容器中加入一定量的反应物发生上述反应。该反应的逆反应速率与时间的关系如图所示:

①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,试判断t8时改变的条件可能是:
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
(4)Cr2O3为重要铬系产品,我国科学家采用Cr2O3(SG)和H-SAPO-34复合催化剂极大提高短链烯烃选择性。CO2和H2在催化剂Cr2O3(SG)表面转化为甲醇的各步骤所需要克服的能垒及甲醇在H-SAPO-34作用下产生乙烯、丙烯示意图如图。

①吸附态用*表示,CO2→甲氧基(H3CO∗)过程中,
②H-SAPO-34具有氧八元环构成的笼状结构(直径0.94nm),笼口为小的八环孔(直径0.38nm)。从结构角度推测、短链烯烃选择性提高的原因是
您最近一年使用:0次
14-15高二上·辽宁沈阳·期末
2 . 某酸性工业废水中含有 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
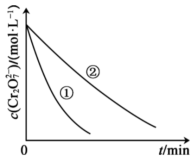
(2)实验①和②的结果表明___________ 对该反应的速率有影响。
(3)该课题组对铁明矾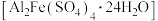 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):
假设一: 起催化作用;
起催化作用;
假设二:___________ ;
假设三:___________ ;……
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有 、
、 、
、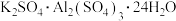 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。
 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾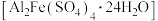 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25
 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 10 | 30 | |
| ② | 5 | 60 | 10 | |
| ③ | 60 | 20 |
测得实验①和②溶液中的
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)实验①和②的结果表明
(3)该课题组对铁明矾
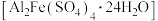 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):假设一:
 起催化作用;
起催化作用;假设二:
假设三:
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有
 、
、 、
、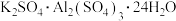 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取 | 反应进行相同时间后:若溶液中的 浓度,则假设一成立;若溶液中的 浓度,则假设一成立;若溶液中的 浓度 浓度 |
您最近一年使用:0次
2021-03-09更新
|
131次组卷
|
4卷引用:2013-2014学年辽宁省沈阳市高二上教学质量监测化学试卷
(已下线)2013-2014学年辽宁省沈阳市高二上教学质量监测化学试卷(已下线)2014届辽宁省沈阳市高二上教学质量监测化学试卷 广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题安徽省滁州九校2021-2022学年高二上学期第四次调研考试化学试题
解题方法
3 . 某温度下,在2L容器中有3种气体物质进行反应,X、Y、Z三种物质的量随时间的变化曲线如图所示。
(1)该反应的化学方程式是___________________ 。
(2)若t=10 min,则Y的平均反应速率是__________ ,想要提高反应速率,可适当采取的措施是________ ,________ ,_______ 。(填三个)

(1)该反应的化学方程式是
(2)若t=10 min,则Y的平均反应速率是
您最近一年使用:0次
解题方法
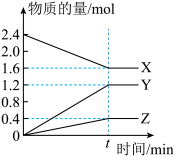
4 . 汽车尾气中通常含有NO和CO等大气污染物,某课题组依据反应2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-749 kJ·mol-1探究减少汽车尾气对大气的污染的方法,重点探究如何提高汽车尾气的转化速率。
N2(g)+2CO2(g) △H=-749 kJ·mol-1探究减少汽车尾气对大气的污染的方法,重点探究如何提高汽车尾气的转化速率。
(1)实验设计的部分数据如下表,按序号填写表格空白
(2)该课题组探究的是___________ 对反应速率的影响。
(3)三组实验c(CO)随时间变化如图一所示。通过图中___________ 两条曲线可知,催化效率较高的催化剂是___________ (填成分);第III组实验中,达平衡时c(NO)为___________ 。
(4)相同温度下,催化剂对反应过程中能量变化的影响对比如图二所示,其中与图一曲线II对应的曲线是___________ (填“a”、“b”或“c”)。
 N2(g)+2CO2(g) △H=-749 kJ·mol-1探究减少汽车尾气对大气的污染的方法,重点探究如何提高汽车尾气的转化速率。
N2(g)+2CO2(g) △H=-749 kJ·mol-1探究减少汽车尾气对大气的污染的方法,重点探究如何提高汽车尾气的转化速率。(1)实验设计的部分数据如下表,按序号填写表格空白
| 编号 | t/℃ | c(NO)/mol·L-1 | c(CO)/mol·L-1 | 催化剂 |
| Ⅰ | 280 | 5.50×10-3 | 4.00×10-3 | Cu—Co—Ce |
| Ⅱ | ① | ② | 4.00×10-3 | Pd—Pt—Rh |
| Ⅲ | 360 | 5.50×10-3 | ③ | Pd—Pt—Rh |
(3)三组实验c(CO)随时间变化如图一所示。通过图中
(4)相同温度下,催化剂对反应过程中能量变化的影响对比如图二所示,其中与图一曲线II对应的曲线是

您最近一年使用:0次
名校
5 . (1)为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
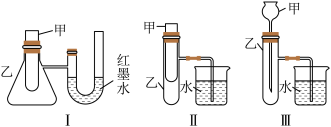
①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是___________ (填序号)。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是_________ 。
③除了图示某些装置,还有其它方法能证明超氧化钾粉末与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是________ 反应(填“放热”或“吸热”)。
(2)化学反应的焓变通常用实验进行测定,也可进行理论推算。
①实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧热的热化学方程式:_______ ;
②已知反应CH3—CH3(g)→CH2=CH2(g)+H2(g) ΔH,有关化学键的键能如下:
通过计算得出该反应的焓变ΔH=_________ ;
(3)研究NO2、SO2、CO等大气污染气体的处理有重要意义。
如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134kJ·mol-1,E2=368kJ·mol-1(E1、E2为反应的活化能)。
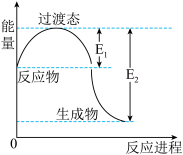
若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________ 、________ (填“增大”、“减小”或“不变”);该反应放出的热量为__________ kJ。

①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是
③除了图示某些装置,还有其它方法能证明超氧化钾粉末与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是
(2)化学反应的焓变通常用实验进行测定,也可进行理论推算。
①实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧热的热化学方程式:
②已知反应CH3—CH3(g)→CH2=CH2(g)+H2(g) ΔH,有关化学键的键能如下:
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.3 | 435.3 |
通过计算得出该反应的焓变ΔH=
(3)研究NO2、SO2、CO等大气污染气体的处理有重要意义。
如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134kJ·mol-1,E2=368kJ·mol-1(E1、E2为反应的活化能)。

若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是
您最近一年使用:0次
2020-10-16更新
|
238次组卷
|
2卷引用:辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题
解题方法
6 . 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
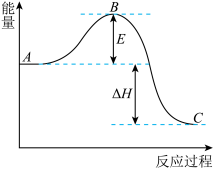
(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点______ (填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响_______ 。
(3)图中A表示SO2(g)和O2(g)的_________ 。
(4)图中△H的意义是__________ 。
(5)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式_____ ,_____ ;
(6)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________ 。
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点
(2)E的大小对该反应的反应热有无影响
(3)图中A表示SO2(g)和O2(g)的
(4)图中△H的意义是
(5)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式
(6)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
您最近一年使用:0次
2008·海南·高考真题
真题
名校
7 . 反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
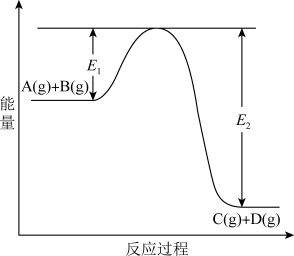
(1)该反应是____________________ 反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______ (填“增大”“减小”“不变”),原因是_______________________________ ;
(3)反应体系中加入催化剂对反应热是否有影响?________ ,原因是_________ :
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________ ,E2________ (填“增大”“减小、”“不变”)。
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
您最近一年使用:0次
2019-01-30更新
|
1402次组卷
|
19卷引用:2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷
(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2010年河南省长葛三高高二上学期第一次考试化学试题(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期中考试化学试卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷2015-2016学年山东省临沂市第十九中学高二上10月月考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题【全国百强校】宁夏回族自治区育才中学2018-2019学年高二上学期第一次(9月)月考化学试题山西省运城市稷山中学2019-2020学年高二上学期第一次月考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题2008年普通高等学校招生统一考试化学试题(海南卷)2015-2016学年海南文昌中学高一下期末考化学(理)试题2015-2016学年青海省西宁市第五中学高一下学期期末(理)化学试卷山西省怀仁县第八中学2016-2017学年高一(普通班)下学期期末考试化学试题



