名校
1 . 用 、
、 和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1: ;
; 。总反应的化学方程式为:
。总反应的化学方程式为:_______ , 在该反应中的作用
在该反应中的作用_________ 。
(2)资料2: 分解反应过程中能量变化如图所示,其中①有
分解反应过程中能量变化如图所示,其中①有 加入,②无
加入,②无 加入。下列判断正确的是
加入。下列判断正确的是___________ (填字母)。
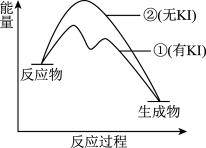
A.加入 后降低了反应所需的活化能
后降低了反应所需的活化能
B.加入 后该反应的活化分子百分数减小
后该反应的活化分子百分数减小
C. 是放热反应
是放热反应
(3)实验中发现, 与
与 溶液混合后,产生大量气泡,溶液颜色变黄。再加入
溶液混合后,产生大量气泡,溶液颜色变黄。再加入 ,振荡、静置,气泡明显减少。
,振荡、静置,气泡明显减少。
资料3: 也可催化
也可催化 的分解反应。
的分解反应。
①加 并振荡、静置后还可观察到
并振荡、静置后还可观察到___________ ,说明有 生成。
生成。
②气泡明显减少的原因可能是:i. 浓度降低;
浓度降低;
ii.___________ 。
③以下对照实验说明ii不是主要原因:向 溶液中加入
溶液中加入 溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管中加入
溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管中加入 ,B试管中不加
,B试管中不加 ,分别振荡、静置。观察到的现象是
,分别振荡、静置。观察到的现象是________ 。
(4)资料4: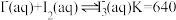 。为了探究体系中含碘微粒的存在形式,进行实验:向
。为了探究体系中含碘微粒的存在形式,进行实验:向 一定浓度的
一定浓度的 溶液中加入
溶液中加入 溶液(溶液混合时体积变化忽略不计),达平衡后,相关微粒浓度如下:
溶液(溶液混合时体积变化忽略不计),达平衡后,相关微粒浓度如下:
则a=___________ ,进而推出该平衡体系中除了含有 、
、 、
、 外,一定还含有其他含碘微粒。
外,一定还含有其他含碘微粒。
 、
、 和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。(1)资料1:
 ;
; 。总反应的化学方程式为:
。总反应的化学方程式为: 在该反应中的作用
在该反应中的作用(2)资料2:
 分解反应过程中能量变化如图所示,其中①有
分解反应过程中能量变化如图所示,其中①有 加入,②无
加入,②无 加入。下列判断正确的是
加入。下列判断正确的是
A.加入
 后降低了反应所需的活化能
后降低了反应所需的活化能B.加入
 后该反应的活化分子百分数减小
后该反应的活化分子百分数减小C.
 是放热反应
是放热反应(3)实验中发现,
 与
与 溶液混合后,产生大量气泡,溶液颜色变黄。再加入
溶液混合后,产生大量气泡,溶液颜色变黄。再加入 ,振荡、静置,气泡明显减少。
,振荡、静置,气泡明显减少。资料3:
 也可催化
也可催化 的分解反应。
的分解反应。①加
 并振荡、静置后还可观察到
并振荡、静置后还可观察到 生成。
生成。②气泡明显减少的原因可能是:i.
 浓度降低;
浓度降低;ii.
③以下对照实验说明ii不是主要原因:向
 溶液中加入
溶液中加入 溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管中加入
溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管中加入 ,B试管中不加
,B试管中不加 ,分别振荡、静置。观察到的现象是
,分别振荡、静置。观察到的现象是(4)资料4:
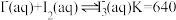 。为了探究体系中含碘微粒的存在形式,进行实验:向
。为了探究体系中含碘微粒的存在形式,进行实验:向 一定浓度的
一定浓度的 溶液中加入
溶液中加入 溶液(溶液混合时体积变化忽略不计),达平衡后,相关微粒浓度如下:
溶液(溶液混合时体积变化忽略不计),达平衡后,相关微粒浓度如下:| 微粒 |  |  |  |
浓度/( ) ) |  | a |  |
 、
、 、
、 外,一定还含有其他含碘微粒。
外,一定还含有其他含碘微粒。
您最近一年使用:0次
2 . 目前,常用三元催化将汽车尾气中NO和CO转化为CO2和N2。在密闭容器中模拟进行如下反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
(1)增加CO的浓度,平衡向_______ 移动,该反应的平衡常数K_______ 。
(2)保持反应容器压强和温度不变,通入He,平衡向_______ 移动,该化学反应速率_______ ,该反应的△H_______ 。
(3)在一定温度下,缩小反应容器体积,平衡向_______ 移动,NO(g)的转化率_______ 。
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡_______ 移动,该化学反应速率将_______ 。
 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。(1)增加CO的浓度,平衡向
(2)保持反应容器压强和温度不变,通入He,平衡向
(3)在一定温度下,缩小反应容器体积,平衡向
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡
您最近一年使用:0次
2023-11-05更新
|
262次组卷
|
2卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
名校
3 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,回答下列问题:
(1)通过实验A、B,可探究___________ 的改变对反应速率的影响,其中
___________ ,T1=___________ ;通过实验___________ (填序号)可探究出温度变化对化学反应速率的影响。
(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。(保留2位有效数字)
(3)写出该反应的离子方程式___________ 。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
①结合实验目的与表中数据,你得出的结论是___________ 。
②从影响化学反应速率的因素看,你认为还可能是___________ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是___________ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol/L | V/mL | c/mol/L | V/mL | |||
| A | 293 | 20 | 0.2 | 40 | 1 | 0 | t1 |
| B | T1 | 20 | 0.2 | 30 | 1 | V1 | 8 |
| C | 313 | 20 | 0.2 | V2 | 1 | 0 | t2 |

(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)写出该反应的离子方程式
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| 温度/℃ | 20 | 21 | 21 | 21.5 | 22 | 22 |
②从影响化学反应速率的因素看,你认为还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
您最近一年使用:0次
2023-10-30更新
|
243次组卷
|
2卷引用:四川省内江市第二中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
4 . 实验室利用下列方案探究影响化学反应速率的因素,实验时,分别量取 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定 溶液褪色时间来判断反应的快慢。请回答相关问题:
溶液褪色时间来判断反应的快慢。请回答相关问题:
(1)该反应的离子方程式为___________ 。
(2)实验①、②、③所加 溶液均要过量,理由是
溶液均要过量,理由是___________ 。
(3)实验①和实验②是探究___________ 对化学反应速率的影响。
(4)实验②测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=___________ 。
(5)实验①和②起初反应均很慢,过了一会儿速率突然增大,可能原因是___________ 。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的___________ (填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定 溶液褪色时间来判断反应的快慢。请回答相关问题:
溶液褪色时间来判断反应的快慢。请回答相关问题:| 编号 | 温度/℃ |  溶液 溶液 | 酸性 溶液 溶液 | ||
浓度/ | 体积/ | 浓度/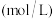 | 体积/ | ||
| ① | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| ② | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| ③ | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
(2)实验①、②、③所加
 溶液均要过量,理由是
溶液均要过量,理由是(3)实验①和实验②是探究
(4)实验②测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
(5)实验①和②起初反应均很慢,过了一会儿速率突然增大,可能原因是
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
您最近一年使用:0次
2023-10-07更新
|
29次组卷
|
2卷引用:四川省绵阳南山中学实验学校2023-2024学年高二上学期9月月考化学试题
名校
解题方法
5 . 汽车尾气中的主要污染物是NOx和CO,它们是现代化城市中的重要大气污染物。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是_______ ,图1中对应反应的热化学方程式为________________ 。
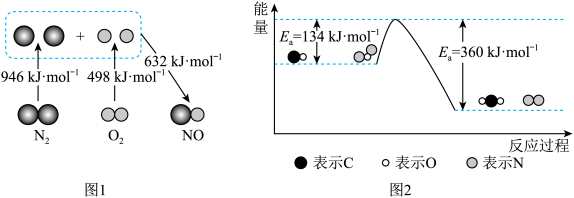
(2)N2O和CO均是有害气体,可在 表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。
表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。
①图2中反应是_______ (填“放热”或“吸热”)反应,该反应的活化能为_______ ,该反应的ΔH=_______ ;
②在反应体系中加入Pt2O+作为该反应的催化剂,则Ea_______ (填“增大”“减小”或“不变”,下同), ΔH _______ 。
(3)利用NH3还原法可将NOx还原为N2进行脱除。已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH=﹣2070 kJ·mol-1
若有0.5 mol NO被还原,则_____ (填“释放”或“吸收”)的热量为______ 。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是

(2)N2O和CO均是有害气体,可在
 表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。
表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。①图2中反应是
②在反应体系中加入Pt2O+作为该反应的催化剂,则Ea
(3)利用NH3还原法可将NOx还原为N2进行脱除。已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH=﹣2070 kJ·mol-1
若有0.5 mol NO被还原,则
您最近一年使用:0次
2021-11-17更新
|
856次组卷
|
5卷引用:四川省自贡市第一中学校2023-2024学年高二上学期10月月考化学试题



