解题方法
1 . 二氧化碳加氢制甲烷过程中的主要反应为
Ⅰ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
Ⅲ.2CO(g)+2H2(g)=CO2(g)+CH4(g) △H3
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,在催化剂作用下反应相同时间所测得的CO2平衡转化率、CO2实际转化率随温度的变化如图2所示。CH4的选择性可表示为 ×100%。
×100%。
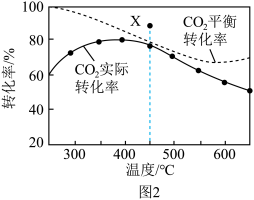
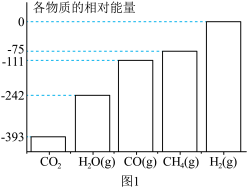
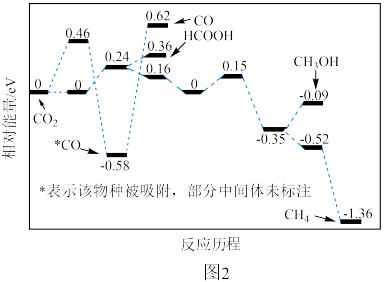
(1)各物质的相对能量如图1所示,△H3=______ kJ•mol-1,平衡时CH4的选择性随着温度的升高______ ,用该催化剂催化二氧化碳反应的最佳温度为______ ,450℃时,使CO2平衡转化率达到X点的值,可以采用的措施为_______ (写出一条)。
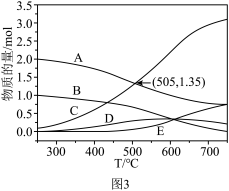
(2)在密闭容器中,1.01×105Pa,CO2和H2的起始物质的量分别为1mol和4mol,平衡后反应体系中各物质的物质的量随温度的变化如图3所示,图中表示CH4的物质的量的曲线为______ 。在505℃,反应Ⅱ的平衡常数K=______ 。(保留两位有效数字)
(3)CeO2催化CO2与H2转化为CH4的机理如图4所示。反应体系中Ce呈现______ 种价态,催化剂中掺入少量CaO,用Ca2+替代CeO2结构中部分Ce4+形成CaxCe1-xOy,可提高催化效率的原因是_______ 。

Ⅰ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
Ⅲ.2CO(g)+2H2(g)=CO2(g)+CH4(g) △H3
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,在催化剂作用下反应相同时间所测得的CO2平衡转化率、CO2实际转化率随温度的变化如图2所示。CH4的选择性可表示为
 ×100%。
×100%。
(1)各物质的相对能量如图1所示,△H3=

(2)在密闭容器中,1.01×105Pa,CO2和H2的起始物质的量分别为1mol和4mol,平衡后反应体系中各物质的物质的量随温度的变化如图3所示,图中表示CH4的物质的量的曲线为

(3)CeO2催化CO2与H2转化为CH4的机理如图4所示。反应体系中Ce呈现

您最近一年使用:0次
2 .  的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。
Ⅰ.热化学法处理 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是___________ 。
(2)该反应的正逆反应速率可分别表示为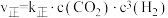 ,
,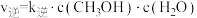 ,其中
,其中 、
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为___________ (填“ ”“
”“ ”“
”“ ”或“
”或“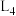 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在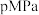 下,将
下,将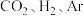 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
___________  。
。
(4)实际合成反应时,也会有 等生成。在恒压条件下
等生成。在恒压条件下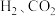 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:

①合成 最适宜的温度为
最适宜的温度为___________
②在 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是___________ 。
Ⅱ.回收利用工业废气中的 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
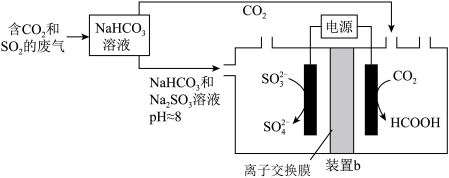
(5)反应后装置b中溶液
___________ (填“增大”、“减小”或“不变”),装置b中的总反应的离子方程式为___________ 。
 的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。Ⅰ.热化学法处理
 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是
(2)该反应的正逆反应速率可分别表示为
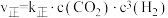 ,
,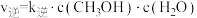 ,其中
,其中 、
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为 ”“
”“ ”“
”“ ”或“
”或“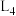 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在
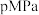 下,将
下,将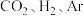 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
 。
。(4)实际合成反应时,也会有
 等生成。在恒压条件下
等生成。在恒压条件下 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:
①合成
 最适宜的温度为
最适宜的温度为②在
 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是Ⅱ.回收利用工业废气中的
 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
(5)反应后装置b中溶液

您最近一年使用:0次
解题方法
3 . 钴(Co)合金广泛应用于机械制造等领域。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为_____ 。
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。
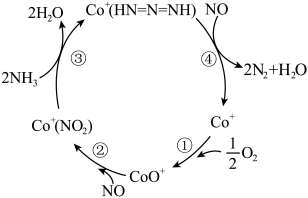
①在反应②中NO作_____ (填“氧化剂”或“还原剂”),与反应④中NO的作用_____ (填“是”或“不是”)一样的。
②写出步骤③对应的离子方程式:_____ 。
③整个历程中氧化剂与还原剂的物质的量之比为_____ 。
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:_____ 。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。

①在反应②中NO作
②写出步骤③对应的离子方程式:
③整个历程中氧化剂与还原剂的物质的量之比为
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:
您最近一年使用:0次
名校
4 . 杭州亚运会主火炬燃料是“零碳甲醇”,这是一种利用焦炉气中的 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)
_______ 。
(2)在密闭容器中充有2molCO和 ,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
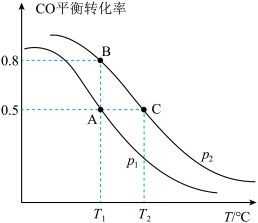
若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积_______ (填“大于”、“=”或“小于”)2L。若反应进行1min达到平衡状态C,用CO的分压变化表示的平均反应速率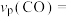
_______  ,此时的化学平衡常数
,此时的化学平衡常数
_______ [ 是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
(3)不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
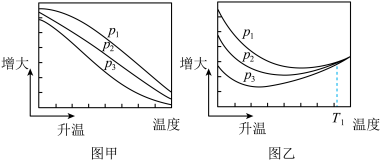
已知: 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率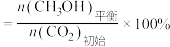
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图_______ (填“甲”或“乙”);压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ;图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是_______ 。
(4)催化还原法
① 与丙烯通过金属杂多酸盐
与丙烯通过金属杂多酸盐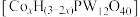 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对
催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对 转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是_______ 。
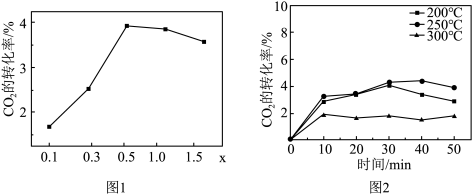
②催化剂在温度不同时对 转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因_______ 。
 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)在密闭容器中充有2molCO和
 ,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积
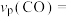
 ,此时的化学平衡常数
,此时的化学平衡常数
 是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。(3)不同压强下,按照
 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率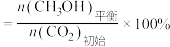
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是(4)催化还原法
①
 与丙烯通过金属杂多酸盐
与丙烯通过金属杂多酸盐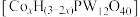 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对
催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对 转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
②催化剂在温度不同时对
 转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
您最近一年使用:0次
名校
5 . 研究 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
I.
II.
(1)一定条件下,速率常数与活化能、温度的关系式为 (R、C为常数,k为速率常数,
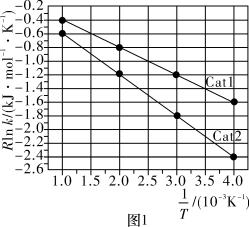
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
在Cat2作用下,该反应的活化能 为
为___________  ;催化效果更好的是
;催化效果更好的是___________ (填“Cat1”或“Cat2”)。
(2) 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
若反应I、II均达到平衡时, ;则表中
;则表中
___________ ;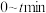 内,
内, 的分压变化率为
的分压变化率为___________  ;反应I的平衡常数
;反应I的平衡常数
___________ 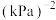 。
。
(3) 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:
主反应:
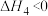
副反应:

若将 和
和 按体积比为
按体积比为 混合(
混合(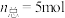 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
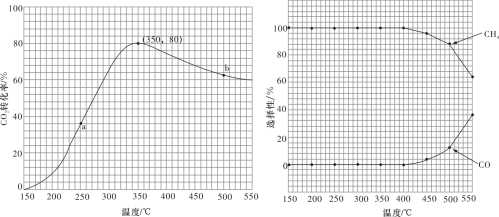
①a点的正反应速率和逆反应速率的大小关系为
___________ (填“>”“=”或“<”) 。
。
②催化剂在较低温度时主要选择___________ (填“主反应”或“副反应”)。
③350~400℃时; 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是___________ 。
 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:I.

II.

(1)一定条件下,速率常数与活化能、温度的关系式为
 (R、C为常数,k为速率常数,
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。在Cat2作用下,该反应的活化能
 为
为 ;催化效果更好的是
;催化效果更好的是
(2)
 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:| 物质的量/mol | 总压强/kPa | |||||
 |  |  | CO |  | ||
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 |  |
| 平衡 | n | 0.3 | p | |||
 ;则表中
;则表中
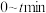 内,
内, 的分压变化率为
的分压变化率为 ;反应I的平衡常数
;反应I的平衡常数
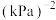 。
。(3)
 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:主反应:

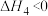
副反应:


若将
 和
和 按体积比为
按体积比为 混合(
混合(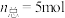 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
①a点的正反应速率和逆反应速率的大小关系为

 。
。②催化剂在较低温度时主要选择
③350~400℃时;
 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是
您最近一年使用:0次
名校
6 . 实验是化学研究的一种重要手段,请完成以下实验的探究与分析。
I.化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式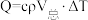 计算获得。
计算获得。
(1)配制0.50 NaOH溶液。
NaOH溶液。
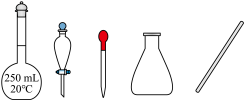
①若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________ g。
②实验中所需的玻璃仪器有烧杯、量筒和___________ 。(从下图中选择,写出名称)
(2)测定热量:将浓度为 的酸溶液和
的酸溶液和 的碱溶液各20mL进行反应。测得反应前后体系的温度值,实验结果见下表。(c和
的碱溶液各20mL进行反应。测得反应前后体系的温度值,实验结果见下表。(c和 分别取
分别取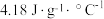 和
和 ,下同)。
,下同)。
①温度:b___________ c(填“>”“<”或“=”),理由是___________ 。
②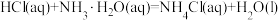 的
的
___________ 。
Ⅱ.碘及其化合物在人类活动中占有重要地位。“大象牙膏”实验中,将H2O2、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
第一步:H2O2+I-=H2O+IO- 慢反应
慢反应
第二步:H2O2+IO-=O2+I-+H2O 快反应
快反应
(3)该反应的决速步骤为___________ ,总反应方程式为___________ 。
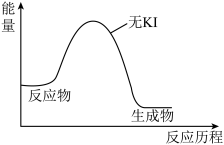
(4)在答题卡的图中画出有KI参与的两步反应的能量历程图___________ 。
I.化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式
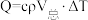 计算获得。
计算获得。(1)配制0.50
 NaOH溶液。
NaOH溶液。①若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体
②实验中所需的玻璃仪器有烧杯、量筒和

(2)测定热量:将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各20mL进行反应。测得反应前后体系的温度值,实验结果见下表。(c和
的碱溶液各20mL进行反应。测得反应前后体系的温度值,实验结果见下表。(c和 分别取
分别取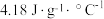 和
和 ,下同)。
,下同)。| 序号 | 体系温度/℃ | ||
| 反应试剂 | 反应前 | 反应后 | |
| i | HCl+NaOH | a | b |
| ii | HCl+NH₃·H₂O | a | c |
②
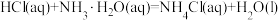 的
的
Ⅱ.碘及其化合物在人类活动中占有重要地位。“大象牙膏”实验中,将H2O2、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
第一步:H2O2+I-=H2O+IO-
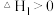 慢反应
慢反应第二步:H2O2+IO-=O2+I-+H2O
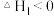 快反应
快反应(3)该反应的决速步骤为
(4)在答题卡的图中画出有KI参与的两步反应的能量历程图

您最近一年使用:0次
7 . 二氧化碳的综合利用具有重要意义。
(1)工业上以 和
和 为原料可以制取合成气(
为原料可以制取合成气( 和
和 )。
)。
①已知 的燃烧热分别为
的燃烧热分别为 ,则反应
,则反应 的
的
________ 。
②将 和
和 以体积比
以体积比 混合后,通过装有催化剂的反应管。下列措施有利于提高
混合后,通过装有催化剂的反应管。下列措施有利于提高 转化率的是
转化率的是________ (填字母)。
a.将反应管控制在催化剂的最大活性温度范围内
b.延长混合气体通过反应管的时间
c.向反应管中加入少量炭粉
(2)电解法转化 可实现
可实现 资源化利用。电解
资源化利用。电解 制
制 的原理如图1所示。
的原理如图1所示。

①写出阴极 还原为
还原为 的电极反应式:
的电极反应式:________ 。
②电解一段时间后,阳极区的 溶液浓度降低,其原因是
溶液浓度降低,其原因是________ 。
(3)一种负载活性金属原子催化剂可催化还原 ,在催化剂表面的物质相对能量与反应历程的关系如图2所示。
,在催化剂表面的物质相对能量与反应历程的关系如图2所示。
①反应中催化剂的活性会因为生成 的不断增多而逐渐减弱,原因是
的不断增多而逐渐减弱,原因是________ 。
② 可由中间体
可由中间体 或
或 经过如图3所示2步转化得到。
经过如图3所示2步转化得到。 和
和 的组成相同,催化剂载体中的活性金属带正电性,
的组成相同,催化剂载体中的活性金属带正电性, 与活性金属结合后的相对能量低于
与活性金属结合后的相对能量低于 。在图4方框内画出
。在图4方框内画出 的结构简式
的结构简式________ 。

(1)工业上以
 和
和 为原料可以制取合成气(
为原料可以制取合成气( 和
和 )。
)。①已知
 的燃烧热分别为
的燃烧热分别为 ,则反应
,则反应 的
的
②将
 和
和 以体积比
以体积比 混合后,通过装有催化剂的反应管。下列措施有利于提高
混合后,通过装有催化剂的反应管。下列措施有利于提高 转化率的是
转化率的是a.将反应管控制在催化剂的最大活性温度范围内
b.延长混合气体通过反应管的时间
c.向反应管中加入少量炭粉
(2)电解法转化
 可实现
可实现 资源化利用。电解
资源化利用。电解 制
制 的原理如图1所示。
的原理如图1所示。

①写出阴极
 还原为
还原为 的电极反应式:
的电极反应式:②电解一段时间后,阳极区的
 溶液浓度降低,其原因是
溶液浓度降低,其原因是(3)一种负载活性金属原子催化剂可催化还原
 ,在催化剂表面的物质相对能量与反应历程的关系如图2所示。
,在催化剂表面的物质相对能量与反应历程的关系如图2所示。①反应中催化剂的活性会因为生成
 的不断增多而逐渐减弱,原因是
的不断增多而逐渐减弱,原因是②
 可由中间体
可由中间体 或
或 经过如图3所示2步转化得到。
经过如图3所示2步转化得到。 和
和 的组成相同,催化剂载体中的活性金属带正电性,
的组成相同,催化剂载体中的活性金属带正电性, 与活性金属结合后的相对能量低于
与活性金属结合后的相对能量低于 。在图4方框内画出
。在图4方框内画出 的结构简式
的结构简式
您最近一年使用:0次
8 . 一种燃煤烟气中 的捕集和资源再利用技术可通过如下转化过程实现。
的捕集和资源再利用技术可通过如下转化过程实现。
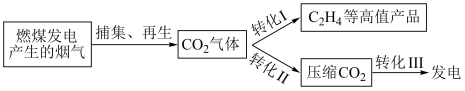
转化I是利用风/太阳能电厂过剩电力,将 转化为
转化为 等高值产品。
等高值产品。
转化II是利用风/太阳能电厂过剩电力驱动压缩机压缩 。
。
转化III是风/太阳能电厂发电低谷时,利用压缩 推动汽轮机,带动发电机发电。
推动汽轮机,带动发电机发电。
(1)利用氨水可捕集烟气中的 捕集、再生过程中含碳物种的变化如图所示。
捕集、再生过程中含碳物种的变化如图所示。

①液相中 发生转化:
发生转化: 。X的结构式为
。X的结构式为___________ 。
②已知: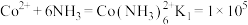

反应 的平衡常数
的平衡常数
___________ 。
③转化后的溶液通过反应 解吸释放
解吸释放 。向两份相同的转化后的溶液中分别加入等体积、等浓度的
。向两份相同的转化后的溶液中分别加入等体积、等浓度的 和
和 溶液,加入
溶液,加入 溶液后释放
溶液后释放 效果更好的原因是
效果更好的原因是___________ 。
(2)以过渡金属作催化剂,利用如图所示装置可实现“转化1”。
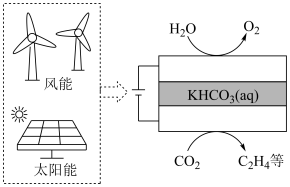
①写出阴极表面的电极反应方程式:___________ 。
②在金属催化剂表面发生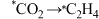 转化的过程可能为
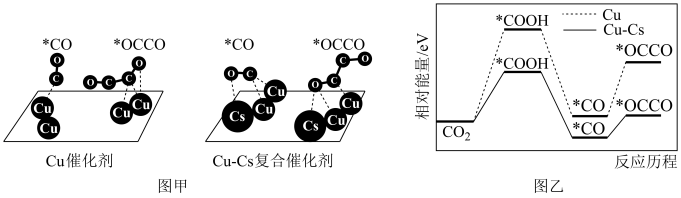
转化的过程可能为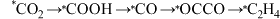 (*表示吸附在催化剂表面)。其中部分物种在催化剂表面的吸附构型如图甲所示,反应历程中的相对能量如图乙所示。与Cu催化剂相比,掺杂了Cs的
(*表示吸附在催化剂表面)。其中部分物种在催化剂表面的吸附构型如图甲所示,反应历程中的相对能量如图乙所示。与Cu催化剂相比,掺杂了Cs的 复合催化剂更有利于
复合催化剂更有利于 的形成,可能原因是
的形成,可能原因是___________ 。
(3)从物质转化与资源综合利用角度分析,本工艺中 的捕集和资源再利用技术的优点是
的捕集和资源再利用技术的优点是___________ 。
 的捕集和资源再利用技术可通过如下转化过程实现。
的捕集和资源再利用技术可通过如下转化过程实现。
转化I是利用风/太阳能电厂过剩电力,将
 转化为
转化为 等高值产品。
等高值产品。转化II是利用风/太阳能电厂过剩电力驱动压缩机压缩
 。
。转化III是风/太阳能电厂发电低谷时,利用压缩
 推动汽轮机,带动发电机发电。
推动汽轮机,带动发电机发电。(1)利用氨水可捕集烟气中的
 捕集、再生过程中含碳物种的变化如图所示。
捕集、再生过程中含碳物种的变化如图所示。
①液相中
 发生转化:
发生转化: 。X的结构式为
。X的结构式为②已知:
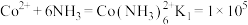

反应
 的平衡常数
的平衡常数
③转化后的溶液通过反应
 解吸释放
解吸释放 。向两份相同的转化后的溶液中分别加入等体积、等浓度的
。向两份相同的转化后的溶液中分别加入等体积、等浓度的 和
和 溶液,加入
溶液,加入 溶液后释放
溶液后释放 效果更好的原因是
效果更好的原因是(2)以过渡金属作催化剂,利用如图所示装置可实现“转化1”。

①写出阴极表面的电极反应方程式:
②在金属催化剂表面发生
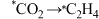 转化的过程可能为
转化的过程可能为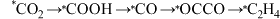 (*表示吸附在催化剂表面)。其中部分物种在催化剂表面的吸附构型如图甲所示,反应历程中的相对能量如图乙所示。与Cu催化剂相比,掺杂了Cs的
(*表示吸附在催化剂表面)。其中部分物种在催化剂表面的吸附构型如图甲所示,反应历程中的相对能量如图乙所示。与Cu催化剂相比,掺杂了Cs的 复合催化剂更有利于
复合催化剂更有利于 的形成,可能原因是
的形成,可能原因是
(3)从物质转化与资源综合利用角度分析,本工艺中
 的捕集和资源再利用技术的优点是
的捕集和资源再利用技术的优点是
您最近一年使用:0次
名校
解题方法
9 . 二氧化碳资源化利用是科研的热点, 甲烷化技术是重要途径之一,其相关反应如下:
甲烷化技术是重要途径之一,其相关反应如下:
ⅰ.
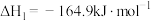
ⅱ.
 ;
;
ⅲ.积炭反应: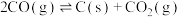
 ;
;
ⅳ.
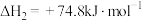 。
。
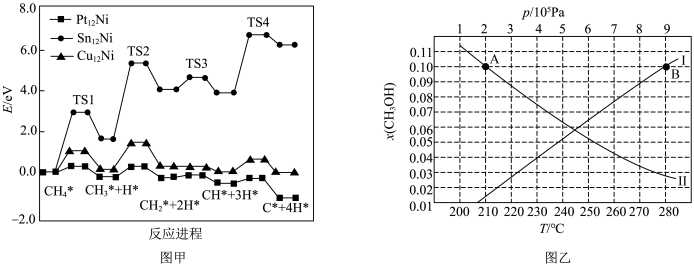
(1)CO歧化积炭反应在低温下能自发进行,则
______ 0(填“>”或“<”)。
(2)研究表明 三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中
三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中 在不同催化剂作用下裂解的反应历程如图甲所示。
在不同催化剂作用下裂解的反应历程如图甲所示。
①该历程分______ 步进行,甲烷逐步脱氢过程中活化能最大的反应步骤是:______ (用化学方程式表示)。
② 双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:
双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:______ 。
(3) 加氢制甲醇也是
加氢制甲醇也是 资源化利用的重要途径之一,其反应原理为
资源化利用的重要途径之一,其反应原理为
 。投料比
。投料比 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为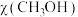 ,在
,在 时
时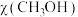 随压强
随压强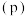 变化关系及在
变化关系及在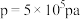 时
时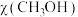 随温度(
随温度( )的曲线变化如图乙所示:
)的曲线变化如图乙所示:
①图中对应等温过程的曲线为______ 。
②图中 两点的速率
两点的速率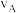
______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③当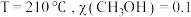 时,
时, 的平衡转化率为
的平衡转化率为______ ; 为210℃时,各物质的平衡分压表示反应的平衡常数
为210℃时,各物质的平衡分压表示反应的平衡常数
______ (列出计算式)。
 甲烷化技术是重要途径之一,其相关反应如下:
甲烷化技术是重要途径之一,其相关反应如下:ⅰ.

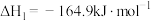
ⅱ.

 ;
;ⅲ.积炭反应:
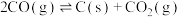
 ;
;ⅳ.

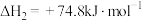 。
。
(1)CO歧化积炭反应在低温下能自发进行,则

(2)研究表明
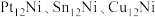 三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中
三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中 在不同催化剂作用下裂解的反应历程如图甲所示。
在不同催化剂作用下裂解的反应历程如图甲所示。①该历程分
②
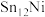 双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:
双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:(3)
 加氢制甲醇也是
加氢制甲醇也是 资源化利用的重要途径之一,其反应原理为
资源化利用的重要途径之一,其反应原理为
 。投料比
。投料比 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为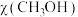 ,在
,在 时
时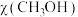 随压强
随压强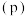 变化关系及在
变化关系及在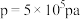 时
时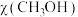 随温度(
随温度( )的曲线变化如图乙所示:
)的曲线变化如图乙所示:①图中对应等温过程的曲线为
②图中
 两点的速率
两点的速率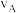
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③当
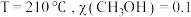 时,
时, 的平衡转化率为
的平衡转化率为 为210℃时,各物质的平衡分压表示反应的平衡常数
为210℃时,各物质的平衡分压表示反应的平衡常数
您最近一年使用:0次
名校
10 . 氢气是一种理想的绿色清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为___________ 。
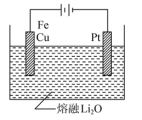
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为___________ 。
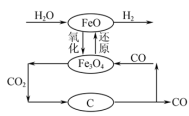
(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是___________ 。
(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。
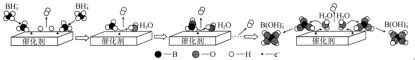
①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有___________ 。
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是___________ 。

(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为

(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是

(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。

①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是

您最近一年使用:0次



