杭州亚运会主火炬燃料是“零碳甲醇”,这是一种利用焦炉气中的 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)
_______ 。
(2)在密闭容器中充有2molCO和 ,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
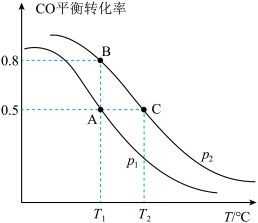
若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积_______ (填“大于”、“=”或“小于”)2L。若反应进行1min达到平衡状态C,用CO的分压变化表示的平均反应速率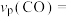
_______  ,此时的化学平衡常数
,此时的化学平衡常数
_______ [ 是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
(3)不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
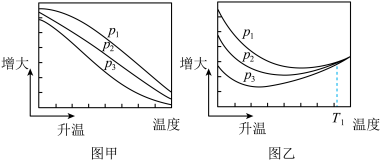
已知: 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率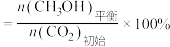
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图_______ (填“甲”或“乙”);压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ;图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是_______ 。
(4)催化还原法
① 与丙烯通过金属杂多酸盐
与丙烯通过金属杂多酸盐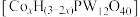 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对
催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对 转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是_______ 。
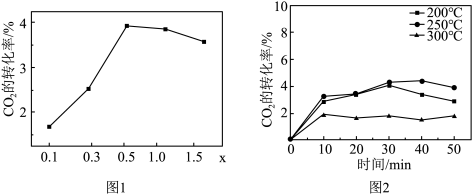
②催化剂在温度不同时对 转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因_______ 。
 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)在密闭容器中充有2molCO和
 ,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积
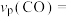
 ,此时的化学平衡常数
,此时的化学平衡常数
 是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。(3)不同压强下,按照
 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率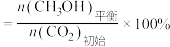
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是(4)催化还原法
①
 与丙烯通过金属杂多酸盐
与丙烯通过金属杂多酸盐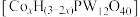 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对
催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对 转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
②催化剂在温度不同时对
 转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
更新时间:2024-03-13 12:54:52
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害,工业上用于合成除草剂、杀草丹、燕麦敌、杀虫剂巴丹等。其结构与 类似。工业上一般通过
类似。工业上一般通过 或者CO与
或者CO与 反应制取COS,发生的相关反应如下:
反应制取COS,发生的相关反应如下:
i.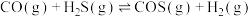
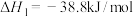
ii.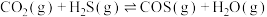
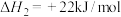
iii.

(1)
_______ 。
(2)COS的中心原子的杂化方式为_______ 。
(3)在一定温度下,将4molCO和 通入一固定容积的密闭容器中发生上述反应i。
通入一固定容积的密闭容器中发生上述反应i。
①能证明上述反应达到平衡的标志是_______ (填字母)。
A.CO和 的转化率相等 B.
的转化率相等 B. 的体积分数不再变化
的体积分数不再变化
C.混合气体的密度不再变化 D.CO、 、COS、
、COS、 浓度之比为1:1:1:1
浓度之比为1:1:1:1
②上述反应达到平衡后,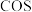 所占的体积分数为12.5%,则该反应的平衡常数为
所占的体积分数为12.5%,则该反应的平衡常数为_______ (保留两位有效数字)。若此时再向体系中加入0.5molCO和 ,平衡将
,平衡将_______ (填“向正反应方向”“向逆反应方向”或“不”)移动;理由是_______ 。
(4)将4molCO和 通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点
通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点_______ (填“是”或“不是”)平衡状态,判断的理由是_______ 。 、1molCO和
、1molCO和 通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、
通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、 和
和 平衡时的转化率如图所示,
平衡时的转化率如图所示, 转化率先减小后增大的原因是
转化率先减小后增大的原因是_______ 。
 类似。工业上一般通过
类似。工业上一般通过 或者CO与
或者CO与 反应制取COS,发生的相关反应如下:
反应制取COS,发生的相关反应如下:i.
ii.
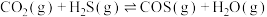
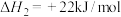
iii.


(1)

(2)COS的中心原子的杂化方式为
(3)在一定温度下,将4molCO和
 通入一固定容积的密闭容器中发生上述反应i。
通入一固定容积的密闭容器中发生上述反应i。①能证明上述反应达到平衡的标志是
A.CO和
 的转化率相等 B.
的转化率相等 B. 的体积分数不再变化
的体积分数不再变化C.混合气体的密度不再变化 D.CO、
 、COS、
、COS、 浓度之比为1:1:1:1
浓度之比为1:1:1:1②上述反应达到平衡后,
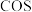 所占的体积分数为12.5%,则该反应的平衡常数为
所占的体积分数为12.5%,则该反应的平衡常数为 ,平衡将
,平衡将(4)将4molCO和
 通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点
通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点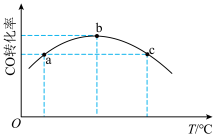
 、1molCO和
、1molCO和 通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、
通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、 和
和 平衡时的转化率如图所示,
平衡时的转化率如图所示, 转化率先减小后增大的原因是
转化率先减小后增大的原因是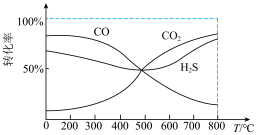
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】中国科学院大连化学物理研究所的“甲醇制取低碳烯经( 技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
(1)煤气化包含一系列化学反应,已知热化学方程式:




则反应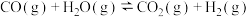

_____ 
(2)以投料比 合成甲醇:
合成甲醇: ,温度、压强与
,温度、压强与 的平衡转化率的关系如图所示
的平衡转化率的关系如图所示

回答下列问题:
①
_____ (填>”或“<)0
②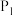
______ (填“>“或“<”)
③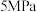 ,
, 时,
时, 点的
点的
_____ (填>”或"<") 。
。
④若起始时提高投料比 的平衡转化率将
的平衡转化率将_______ (填”增大”或“减小”)。
⑤参照下表,实际工业生产中大多采用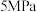 和
和 ,其优点是
,其优点是____________ 。
(3) 和
和 生成
生成 的反应为
的反应为
 ,在
,在 催化剂作用下的反应历程如下(
催化剂作用下的反应历程如下( 表示吸附态)
表示吸附态)
化学吸附: ;
;
表面反应 ;
; ,
,
脱附:
其中, 的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
①有利于提高合成氨平衡产率的条件有______ (填字母)
A低温B高温C低压D高压E催化剂
②标准平衡常数 =
= ,其中
,其中 为标准压强(
为标准压强(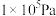 ),
), 、
、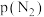 和
和 为各组分的平衡分压,如
为各组分的平衡分压,如 ,
, 为平衡总压,
为平衡总压, 为平衡系统中
为平衡系统中 的物质的量分数.已知起始时向一密闭容器中投入
的物质的量分数.已知起始时向一密闭容器中投入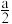
 和
和
 ,反应
,反应
 +
+
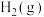

 在恒定温度和标准压强下进行,
在恒定温度和标准压强下进行, 的平衡产率为
的平衡产率为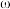 ,则该反应的
,则该反应的 =
=________ (用含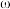 的代数式表示)。下图中可以表示标准平衡常数随温度
的代数式表示)。下图中可以表示标准平衡常数随温度 的变化趋势的是
的变化趋势的是____________ (填字母)

 技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。(1)煤气化包含一系列化学反应,已知热化学方程式:




则反应
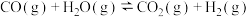


(2)以投料比
 合成甲醇:
合成甲醇: ,温度、压强与
,温度、压强与 的平衡转化率的关系如图所示
的平衡转化率的关系如图所示
回答下列问题:
①

②
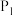

③
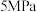 ,
, 时,
时, 点的
点的
 。
。④若起始时提高投料比
 的平衡转化率将
的平衡转化率将⑤参照下表,实际工业生产中大多采用
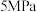 和
和 ,其优点是
,其优点是| 方法 | 催化剂 | 条件 | 备注 | 特点 | |
压力 | 温度 | ||||
| 高压法 |  二元催化剂 | 25~30 | 380~400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
| 低压法 |  三元催化剂 | 5 | 230~270 | 1966年工业化 | (1)催化剂易中毒,再生容易,寿命为1~2年 (2)副反应少 |
(3)
 和
和 生成
生成 的反应为
的反应为
 ,在
,在 催化剂作用下的反应历程如下(
催化剂作用下的反应历程如下( 表示吸附态)
表示吸附态)化学吸附:
 ;
;
表面反应
 ;
; ,
,
脱附:

其中,
 的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.①有利于提高合成氨平衡产率的条件有
A低温B高温C低压D高压E催化剂
②标准平衡常数
 =
= ,其中
,其中 为标准压强(
为标准压强(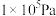 ),
), 、
、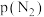 和
和 为各组分的平衡分压,如
为各组分的平衡分压,如 ,
, 为平衡总压,
为平衡总压, 为平衡系统中
为平衡系统中 的物质的量分数.已知起始时向一密闭容器中投入
的物质的量分数.已知起始时向一密闭容器中投入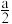
 和
和
 ,反应
,反应
 +
+
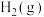

 在恒定温度和标准压强下进行,
在恒定温度和标准压强下进行, 的平衡产率为
的平衡产率为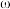 ,则该反应的
,则该反应的 =
=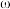 的代数式表示)。下图中可以表示标准平衡常数随温度
的代数式表示)。下图中可以表示标准平衡常数随温度 的变化趋势的是
的变化趋势的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】NO、NO2是大气污染物,但只要合理利用,NO、NO2也是重要的资源。回答下列问题:
(1)氨的合成。已知:N2和H2生成NH3的反应为: N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH=-46.2kJ·mol-1
NH3(g) ΔH=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(※表示吸附态):
化学吸附:N2(g)→2N※;H2(g) 2H※;
2H※;
表面反应:N※+H※ NH※;NH※+H※
NH※;NH※+H※ NH2※;NH2※+H※
NH2※;NH2※+H※ NH3※;
NH3※;
脱附:NH3※ NH3(g)
NH3(g)
其中N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。则利于提高合成氨平衡产率的条件有( )
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)NH3还原法可将NO还原为N2进行脱除。已知:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-1530kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol-1
写出NH3还原NO的热化学方程式__ 。
(3)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是__ (填字母代号)。

a.温度 b.压强 c.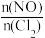 d.与催化剂的接触面积
d.与催化剂的接触面积
(4)在密闭容器中充入4molCO和5molNO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
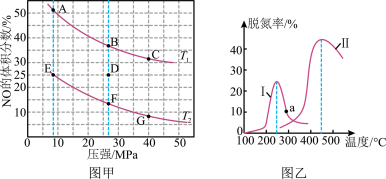
①温度T1__ T2(填“>”或“<”)。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,则重新达到平衡时,D点应向图中A~G点中的__ 点移动。
③探究催化剂对CO、NO转化的影响。某研究小组将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图乙所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为__ ;a点__ (填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由__ 。
(1)氨的合成。已知:N2和H2生成NH3的反应为:
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH=-46.2kJ·mol-1
NH3(g) ΔH=-46.2kJ·mol-1在Fe催化剂作用下的反应历程为(※表示吸附态):
化学吸附:N2(g)→2N※;H2(g)
 2H※;
2H※;表面反应:N※+H※
 NH※;NH※+H※
NH※;NH※+H※ NH2※;NH2※+H※
NH2※;NH2※+H※ NH3※;
NH3※;脱附:NH3※
 NH3(g)
NH3(g)其中N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。则利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)NH3还原法可将NO还原为N2进行脱除。已知:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-1530kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol-1
写出NH3还原NO的热化学方程式
(3)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)
 2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
a.温度 b.压强 c.
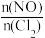 d.与催化剂的接触面积
d.与催化剂的接触面积(4)在密闭容器中充入4molCO和5molNO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
①温度T1
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,则重新达到平衡时,D点应向图中A~G点中的
③探究催化剂对CO、NO转化的影响。某研究小组将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图乙所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察_______ 的快慢,定性比较得出结论。有同学提出将0.1mol/L FeCl3改为_______ mol/L Fe2(SO4)3更为合理。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_______ 。
II.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO +H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
(3)该反应中氧化剂和还原剂的物质的量之比为_______ 。
(4)如果研究催化剂对化学反应速率的影响,使用实验_______ 和_______ (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验_______ 和_______ 。
(5)对比实验I和IV,可以研究_______ 对化学反应速率的影响,实验IV中加入1mL蒸馏水的目的是_______ 。

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
II.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO
 +H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | |
| II | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2 mL | 30 | |
| IV | 1 mL | 20 | 1 mL蒸馏水 |
(4)如果研究催化剂对化学反应速率的影响,使用实验
(5)对比实验I和IV,可以研究
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】工业生产硫酸时,利用催化氧化反应将 转化为
转化为 是一个关键步骤。压强及温度对
是一个关键步骤。压强及温度对 转化率的影响如下表(原料气各成分的体积分数为:
转化率的影响如下表(原料气各成分的体积分数为: 7%,
7%, 11%,
11%, 82%):
82%):
(1)已知 的氧化是放热反应,如何利用表中数据推断此结论?
的氧化是放热反应,如何利用表中数据推断此结论?___________ ;
(2)在400℃~500℃时, 的催化氧化采用常压而不是高压,主要原因是:
的催化氧化采用常压而不是高压,主要原因是:___________ ;
(3)选择适宜的催化剂,是否可以提高 的平衡转化率?
的平衡转化率?___________ (填“是”或“否”),是否可以增大该反应所放出的热量?___________ (填“是”或“否”);
(4)在 催化氧化设备中设置热交器的目的是
催化氧化设备中设置热交器的目的是___________ 、___________ ,从而充分利用能源。
(5)为提高 吸收率,实际生产中用
吸收率,实际生产中用___________ 吸收 ;尾气中
;尾气中 必须回收,主要是为了
必须回收,主要是为了___________ 。
(6)研究表明, 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: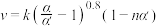 式中:k为反应速率常数,随温度t升高而增大;
式中:k为反应速率常数,随温度t升高而增大; 为
为 平衡转化率,
平衡转化率,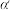 为某时刻
为某时刻 转化率,n为常数。在
转化率,n为常数。在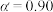 时,将一系列温度下的k、
时,将一系列温度下的k、 值代入上述速率方程,得到
值代入上述速率方程,得到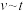 曲线,如下图所示。
曲线,如下图所示。
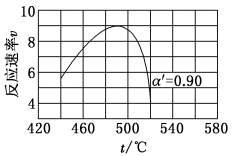
线上v最大值所对应温度称为该 下反应的最适宜温度
下反应的最适宜温度 。
。 时,v逐渐提高:
时,v逐渐提高: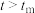 后,v逐渐下降。原因是
后,v逐渐下降。原因是___________ 。
 转化为
转化为 是一个关键步骤。压强及温度对
是一个关键步骤。压强及温度对 转化率的影响如下表(原料气各成分的体积分数为:
转化率的影响如下表(原料气各成分的体积分数为: 7%,
7%, 11%,
11%, 82%):
82%):| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
 的氧化是放热反应,如何利用表中数据推断此结论?
的氧化是放热反应,如何利用表中数据推断此结论?(2)在400℃~500℃时,
 的催化氧化采用常压而不是高压,主要原因是:
的催化氧化采用常压而不是高压,主要原因是:(3)选择适宜的催化剂,是否可以提高
 的平衡转化率?
的平衡转化率?(4)在
 催化氧化设备中设置热交器的目的是
催化氧化设备中设置热交器的目的是(5)为提高
 吸收率,实际生产中用
吸收率,实际生产中用 ;尾气中
;尾气中 必须回收,主要是为了
必须回收,主要是为了(6)研究表明,
 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: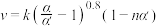 式中:k为反应速率常数,随温度t升高而增大;
式中:k为反应速率常数,随温度t升高而增大; 为
为 平衡转化率,
平衡转化率,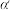 为某时刻
为某时刻 转化率,n为常数。在
转化率,n为常数。在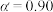 时,将一系列温度下的k、
时,将一系列温度下的k、 值代入上述速率方程,得到
值代入上述速率方程,得到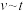 曲线,如下图所示。
曲线,如下图所示。
线上v最大值所对应温度称为该
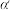 下反应的最适宜温度
下反应的最适宜温度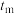 。
。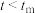 时,v逐渐提高:
时,v逐渐提高: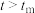 后,v逐渐下降。原因是
后,v逐渐下降。原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】研究 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
I.
II.
(1)一定条件下,速率常数与活化能、温度的关系式为 (R、C为常数,k为速率常数,
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
在Cat2作用下,该反应的活化能 为
为___________  ;催化效果更好的是
;催化效果更好的是___________ (填“Cat1”或“Cat2”)。
(2) 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
若反应I、II均达到平衡时, ;则表中
;则表中
___________ ; 内,
内, 的分压变化率为
的分压变化率为___________  ;反应I的平衡常数
;反应I的平衡常数
___________  。
。
(3) 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:
主反应:
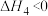
副反应:

若将 和
和 按体积比为
按体积比为 混合(
混合(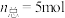 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
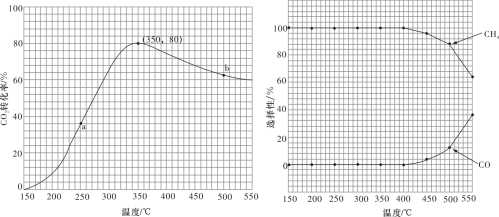
①a点的正反应速率和逆反应速率的大小关系为
___________ (填“>”“=”或“<”) 。
。
②催化剂在较低温度时主要选择___________ (填“主反应”或“副反应”)。
③350~400℃时; 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是___________ 。
 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:I.

II.

(1)一定条件下,速率常数与活化能、温度的关系式为
 (R、C为常数,k为速率常数,
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。在Cat2作用下,该反应的活化能
 为
为 ;催化效果更好的是
;催化效果更好的是
(2)
 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:| 物质的量/mol | 总压强/kPa | |||||
 |  |  | CO |  | ||
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 |  |
| 平衡 | n | 0.3 | p | |||
 ;则表中
;则表中
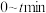 内,
内, 的分压变化率为
的分压变化率为 ;反应I的平衡常数
;反应I的平衡常数
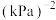 。
。(3)
 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:主反应:

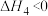
副反应:


若将
 和
和 按体积比为
按体积比为 混合(
混合(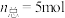 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
①a点的正反应速率和逆反应速率的大小关系为

 。
。②催化剂在较低温度时主要选择
③350~400℃时;
 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】H2S以及COS(羰基硫)是化学工作者重要的研究对象。请回答下列问题:
(1)COS的分子结构与CO2相似,COS的电子式为_________ 。
(2)已知:①COS(g)+H2(g) H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g) H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g) H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
则ΔH3=__________
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是_______ ;当生成两种沉淀时,c(Pb2+)/c(Cu2+)=__________ .
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。

①A点COS的正反应速率_______ (填“大于”“小于”或“等于”)B点COS的逆反应速率。
②在该条件下,COS的平衡转化率为________
③在该温度下,该反应的平衡常数K=__________
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是______
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
(1)COS的分子结构与CO2相似,COS的电子式为
(2)已知:①COS(g)+H2(g)
 H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol②COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol③CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3则ΔH3=
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。

①A点COS的正反应速率
②在该条件下,COS的平衡转化率为
③在该温度下,该反应的平衡常数K=
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
您最近一年使用:0次
【推荐2】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是___________ 。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出CaCO3与SO2脱硫的热化学反应方程式_____________________________________ 。
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
①0~10min内,NO的平均反应速率v(NO)=___________ ,当升高反应温度,该反应的平衡常数K___________ (选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________ (填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________ ;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________ (只列出计算式)(已知:气体分压=气体总压×体积分数)。
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出CaCO3与SO2脱硫的热化学反应方程式
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol反应b:2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
浓度(mol∙L-1) | 时间(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】随着经济的发展,能源与环境问题越来越受到人们的重视和关注,资源利用和环境保护是当前重要研究课题,回答下列问题:
(1)合成气( 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
则反应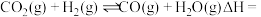
_______  (用含a、b代数式表示),
(用含a、b代数式表示),
_______ 0(填“>”或“<”)。
(2)科学家提出利用 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示:
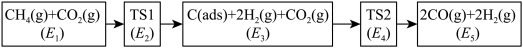
注: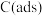 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。
若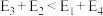 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为_______ 。
(3)一定条件下,向密闭容器中通入一定量的 和
和 制备甲醇,投料比
制备甲醇,投料比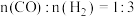 ,反应为
,反应为 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
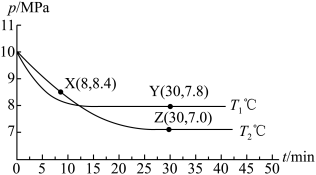
①X点的逆反应速率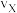 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率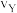 (正)的大小关系:
(正)的大小关系: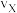 (逆)
(逆)_______ 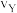 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。
②图中Z点的压强平衡常数
_______ 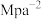 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)利用电化学方法通过微生物电催化将 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
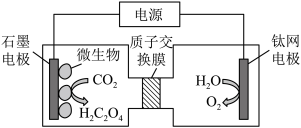
阴极区电极反应式为_______ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_______ 。装置工作时,阴极区除生成 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为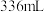 时,测得左池
时,测得左池 的物质的量为
的物质的量为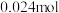 ,则电解效率为
,则电解效率为_______ 。
(1)合成气(
 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:| 热化学方程式 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
Ⅰ.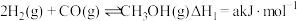 |  | 2.50 | 0.340 | 0.150 |
Ⅱ.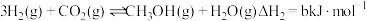 |  | 2.50 | 0.578 | 0.378 |
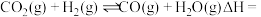
 (用含a、b代数式表示),
(用含a、b代数式表示),
(2)科学家提出利用
 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示: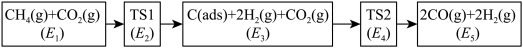
注:
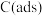 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。若
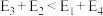 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为(3)一定条件下,向密闭容器中通入一定量的
 和
和 制备甲醇,投料比
制备甲醇,投料比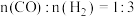 ,反应为
,反应为 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
①X点的逆反应速率
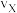 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率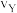 (正)的大小关系:
(正)的大小关系: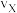 (逆)
(逆)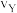 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。②图中Z点的压强平衡常数

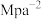 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)利用电化学方法通过微生物电催化将
 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
阴极区电极反应式为
 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为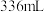 时,测得左池
时,测得左池 的物质的量为
的物质的量为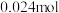 ,则电解效率为
,则电解效率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业生产过程中产生的硫化氢会污染环境,需要回收处理并加以利用。回答下列问题:
(1)硫化氢的水溶液是一种弱酸,硫化氢的电离方程式为___________ 。
(2)我们化学家发明了如图的原电池装置分解硫化氢制氢气并回收硫。
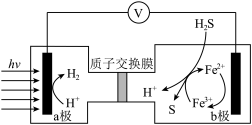
①b极为___________ ,其电极反应式为___________ 。
②该装置的总反应为___________ 。
(3)已知下列反应的热化学方程式:
①
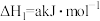
②
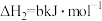
③

计算 热分解反应④:
热分解反应④: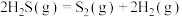 的
的
___________  。
。
(4)反应④的化学平衡常数表达式为___________ 。
(5)在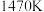 、
、 反应条件下,将
反应条件下,将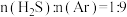 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为___________ ,平衡常数
___________ kPa(用平衡分压 代替平衡浓度计算,分压=总压×物质的量分数。保留一位小数)。达到平衡状态后,若继续向反应器中通入Ar,
代替平衡浓度计算,分压=总压×物质的量分数。保留一位小数)。达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会___________ (填“增大”“减小”或“不变”)。
(1)硫化氢的水溶液是一种弱酸,硫化氢的电离方程式为
(2)我们化学家发明了如图的原电池装置分解硫化氢制氢气并回收硫。

①b极为
②该装置的总反应为
(3)已知下列反应的热化学方程式:
①

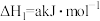
②

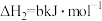
③


计算
 热分解反应④:
热分解反应④: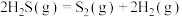 的
的
 。
。(4)反应④的化学平衡常数表达式为
(5)在
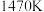 、
、 反应条件下,将
反应条件下,将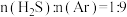 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
 代替平衡浓度计算,分压=总压×物质的量分数。保留一位小数)。达到平衡状态后,若继续向反应器中通入Ar,
代替平衡浓度计算,分压=总压×物质的量分数。保留一位小数)。达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。研发针对二氧化碳的碳捕捉和碳利用技术是其中的关键。
(1)工业尾气中的CO2可以用NaOH溶液捕获。常温下,如果实验测得捕获CO2后的溶液中c( ):c(
):c( )=2:1,则此时溶液的pH=
)=2:1,则此时溶液的pH=_______ (已知常温下,H2CO3的Ka1=4.0×10-7:Ka2=5.0×10-11)。
(2)利用CO2制备甲醇,其反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
已知CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH=-90.8kJ·mol-1
则该反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH=
CH3OH(g)+H2O(g)的ΔH=_______ 。
(3)为探究用CO2生产甲醇的反应原理CO2(g)+3H2(g) CH3OH(g)+H2O(g),现进行如下实验:在2L恒温密闭容器中,充入0.04molCO2和0.08molH2,测得其压强p-t变化(如图1)曲线I所示。
CH3OH(g)+H2O(g),现进行如下实验:在2L恒温密闭容器中,充入0.04molCO2和0.08molH2,测得其压强p-t变化(如图1)曲线I所示。

①用CO2来表示5min内的化学反应速率v(CO2)=_______ 。
②其他条件相同时,若只改变某一条件,曲线由I变化为II,则改变的条件是_______ 。
③该温度下,此反应的平衡常数Kp=_______ Pa-2(保留三位有效数字)。(用平衡分压代替平衡浓度计算,分压=总压×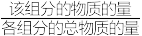 )
)
(4)O2辅助的Al-CO2电池电容量大,能有效捕获利用CO2,其工作原理如图2所示。其中,离子液体是优良的溶剂,具有导电性;电池反应产物Al2(C2O4)3重要的化工原料。此电池的正极区反应式有:6O2+6e-=6 ,
,_______ ,当电解过程中有lmolAl2(C2O4)3生成,则参与反应O2的物质的量是_______ 。

(1)工业尾气中的CO2可以用NaOH溶液捕获。常温下,如果实验测得捕获CO2后的溶液中c(
 ):c(
):c( )=2:1,则此时溶液的pH=
)=2:1,则此时溶液的pH=(2)利用CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。已知CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
CO(g)+H2O(g) ΔH=+41.3kJ·mol-1CO(g)+2H2(g)=CH3OH(g) ΔH=-90.8kJ·mol-1
则该反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的ΔH=
CH3OH(g)+H2O(g)的ΔH=(3)为探究用CO2生产甲醇的反应原理CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),现进行如下实验:在2L恒温密闭容器中,充入0.04molCO2和0.08molH2,测得其压强p-t变化(如图1)曲线I所示。
CH3OH(g)+H2O(g),现进行如下实验:在2L恒温密闭容器中,充入0.04molCO2和0.08molH2,测得其压强p-t变化(如图1)曲线I所示。
①用CO2来表示5min内的化学反应速率v(CO2)=
②其他条件相同时,若只改变某一条件,曲线由I变化为II,则改变的条件是
③该温度下,此反应的平衡常数Kp=
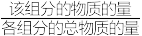 )
)(4)O2辅助的Al-CO2电池电容量大,能有效捕获利用CO2,其工作原理如图2所示。其中,离子液体是优良的溶剂,具有导电性;电池反应产物Al2(C2O4)3重要的化工原料。此电池的正极区反应式有:6O2+6e-=6
 ,
,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】“费托合成”是由1925年德国化学家弗朗兹·费歇尔和汉斯·托罗普施所开发的。其原理是以一氧化碳和氢气的混合气体为原料,在催化剂和适当条件下,合成液态的烃或碳氢化合物。“煤间接液化技术”首创了高温浆态床费托合成工艺,实现了煤间接液化的高油品收率和高能量利用效率。
(1)已知:



计算反应 的
的
_______  ,下列说法能判断该反应达到平衡状态的是
,下列说法能判断该反应达到平衡状态的是_______ (填标号)。
A.
B.单位时间内断裂 键的同时形成
键的同时形成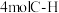 键
键
C.
D.混合气体的平均摩尔质量不再变化
(2)T℃时,在0.5L的恒容密闭器中充入 与
与 ,于初始压强为160kPa下,进行反应:
,于初始压强为160kPa下,进行反应: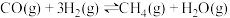 ,
, 时反应达到平衡,此时测得
时反应达到平衡,此时测得 的物质的量分数为50%。则
的物质的量分数为50%。则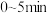 内
内 的反应速率为
的反应速率为_______  ,CO的转化率为
,CO的转化率为_______ %,达到平衡后的
_______ (以气体分压代入平衡常数表达式,列计算式即可)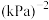 。
。
(3)费托合成反应生成的烃类化合物也可以设计成燃料电池,高温燃料电池通过在电解质中传导 提供能量,排放尾气中只有水蒸气和二氧化碳,经简单冷凝后可获得高浓度二氧化碳,大幅降低了二氧化碳捕集成本。请写出烃
提供能量,排放尾气中只有水蒸气和二氧化碳,经简单冷凝后可获得高浓度二氧化碳,大幅降低了二氧化碳捕集成本。请写出烃 在负极发生的电极反应:
在负极发生的电极反应:_______ ;若放电时,外电路中转移6mol电子,则正极消耗标准状况下氧气的体积为_______ L。
(1)已知:




计算反应
 的
的
 ,下列说法能判断该反应达到平衡状态的是
,下列说法能判断该反应达到平衡状态的是A.

B.单位时间内断裂
 键的同时形成
键的同时形成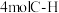 键
键C.

D.混合气体的平均摩尔质量不再变化
(2)T℃时,在0.5L的恒容密闭器中充入
 与
与 ,于初始压强为160kPa下,进行反应:
,于初始压强为160kPa下,进行反应: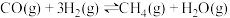 ,
, 时反应达到平衡,此时测得
时反应达到平衡,此时测得 的物质的量分数为50%。则
的物质的量分数为50%。则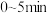 内
内 的反应速率为
的反应速率为 ,CO的转化率为
,CO的转化率为
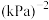 。
。(3)费托合成反应生成的烃类化合物也可以设计成燃料电池,高温燃料电池通过在电解质中传导
 提供能量,排放尾气中只有水蒸气和二氧化碳,经简单冷凝后可获得高浓度二氧化碳,大幅降低了二氧化碳捕集成本。请写出烃
提供能量,排放尾气中只有水蒸气和二氧化碳,经简单冷凝后可获得高浓度二氧化碳,大幅降低了二氧化碳捕集成本。请写出烃 在负极发生的电极反应:
在负极发生的电极反应:
您最近一年使用:0次



