1 . 甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。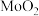 与
与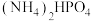 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为_________________ 。
②电解时,电极b上同时产生 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为_____________ 。
③电解过程中每产生1 mol ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为______ mol。
(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为 ,反应的机理如图所示。
,反应的机理如图所示。 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。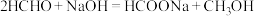 。
。
①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为_______ (填化学式)。
②NaOH浓度低于1 mol⋅L 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是__________ 。
③若NaOH浓度过大, 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是__________________ 。
(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有______________ 。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得
 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
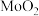 与
与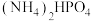 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为②电解时,电极b上同时产生
 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为③电解过程中每产生1 mol
 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为
 ,反应的机理如图所示。
,反应的机理如图所示。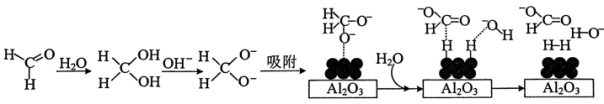
 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
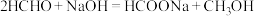 。
。①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为
②NaOH浓度低于1 mol⋅L
 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是③若NaOH浓度过大,
 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有
您最近一年使用:0次
2024-03-24更新
|
1015次组卷
|
5卷引用:江苏省苏锡常镇四市2024届高三一模考试化学试题
名校
解题方法
2 . 氢气作为一种清洁能源,一直是能源研究的热点,水煤气变换反应可用于大规模制 ,反应原理如下:
,反应原理如下:
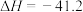 kJ⋅mol
kJ⋅mol
(1)根据下表中提供的数据,计算

 。
。化学键 |
|
|
|
|
键能/kJ·mol | 803 | x | 463 | 436 |
(2)某温度下,在一恒容密闭容器中充入CO和
 ,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为
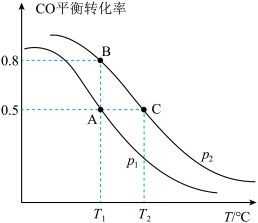
,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为 ,分压如图甲所示(t时刻前,
,分压如图甲所示(t时刻前, 的分压未给出),则A点坐标为(t,
的分压未给出),则A点坐标为(t,
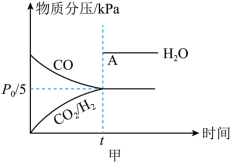
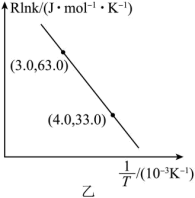
(3)反应
 的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为
的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为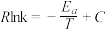 (其中
(其中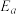 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能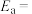
当使用更高效催化剂时,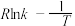
您最近一年使用:0次
3 . 我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I: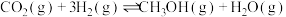
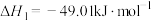
反应Ⅱ: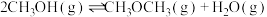
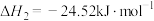
反应Ⅲ:
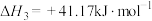
①结合计算分析反应 的自发性:
的自发性:_____ 。
②恒压、投料比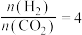 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
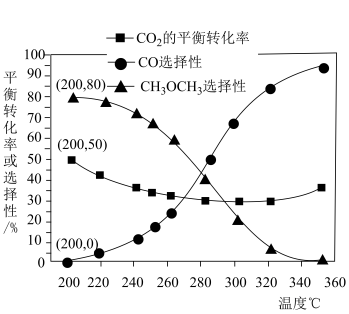
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是_____ 。
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是_____ 。
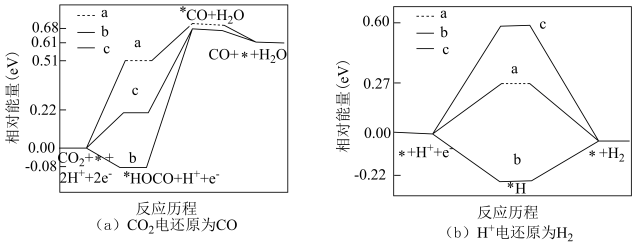
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_____ 。
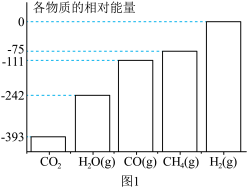
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为_____ (用a、b、c字母排序)。
(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。
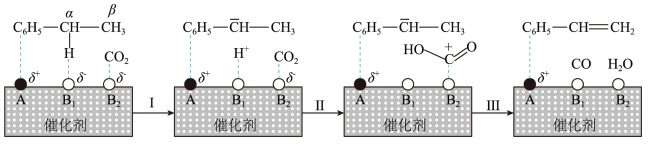
图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:_____ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I:
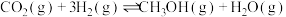
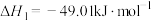
反应Ⅱ:
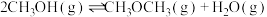
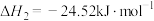
反应Ⅲ:

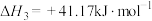
①结合计算分析反应
 的自发性:
的自发性:②恒压、投料比
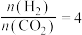 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为

(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。

图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:
您最近一年使用:0次
4 . 乙醇是一种清洁的替代能源,催化加氢制备乙醇技术是当前的研究热点。
(1) 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为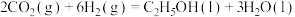 。
。
①若要计算上述反应的 ,须查阅的两个数据是
,须查阅的两个数据是 的燃烧热和
的燃烧热和___________ 。
②某金属有机骨架负载的铜基催化剂上, 加氢生成
加氢生成 的部分反应机理如图所示。
的部分反应机理如图所示。 过程中两个
过程中两个 均参与反应,画出
均参与反应,画出 的结构式(注明电荷)
的结构式(注明电荷)___________ 。
(2)乙酸甲酯催化加氢制备乙醇主要涉及如下反应:
反应Ⅰ:

反应Ⅱ:
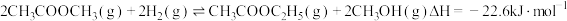
在其他条件不变时,将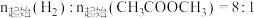 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得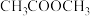 转化率、
转化率、 选择性
选择性 选择性
选择性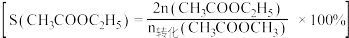 ]随温度的变化如图所示。
]随温度的变化如图所示。 与
与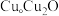 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为___________  (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。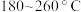 下均有
下均有 ,其原因是
,其原因是___________ 。
③ 范围内,
范围内,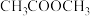 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是___________ 。
④温度高于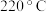 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是___________ 。
(1)
 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为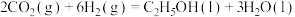 。
。①若要计算上述反应的
 ,须查阅的两个数据是
,须查阅的两个数据是 的燃烧热和
的燃烧热和②某金属有机骨架负载的铜基催化剂上,
 加氢生成
加氢生成 的部分反应机理如图所示。
的部分反应机理如图所示。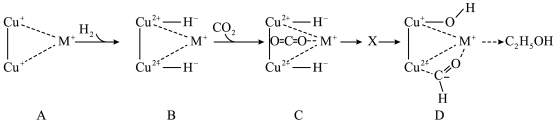
 过程中两个
过程中两个 均参与反应,画出
均参与反应,画出 的结构式(注明电荷)
的结构式(注明电荷)(2)乙酸甲酯催化加氢制备乙醇主要涉及如下反应:
反应Ⅰ:

反应Ⅱ:
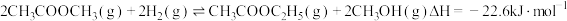
在其他条件不变时,将
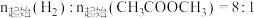 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得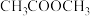 转化率、
转化率、 选择性
选择性 选择性
选择性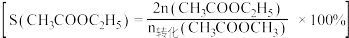 ]随温度的变化如图所示。
]随温度的变化如图所示。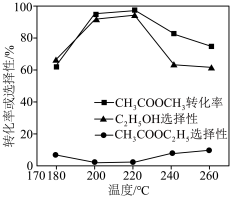
 与
与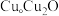 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为 (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。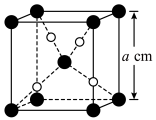
 下均有
下均有 ,其原因是
,其原因是③
 范围内,
范围内,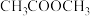 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是④温度高于
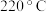 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是
您最近一年使用:0次
2024-03-22更新
|
1024次组卷
|
4卷引用:江苏省南京市盐城市2024届高三一模考试化学试题
江苏省南京市盐城市2024届高三一模考试化学试题(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)专题5 物质结构与性质 元素周期律-晶体结构与性质(已下线)暑假作业15 突破化学反应原理综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)
名校
解题方法
5 . 钢铁冶炼所排放的烟气是造成雾霾的主要大气污染物,其中含有 (
(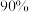 以上为
以上为 )。
)。
回答下列问题:
(1)目前,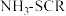 R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是:
R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是:
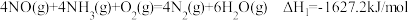
已知: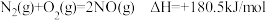 。
。
写出 被
被 直接氧化为
直接氧化为 的热化学方程式
的热化学方程式____________________ 。
(2)对于含 的烟气,可以直接利用
的烟气,可以直接利用 还原
还原 (
( 脱硝技术),生成
脱硝技术),生成 和
和 ,实现“以废治废”。右图为
,实现“以废治废”。右图为 还原
还原 过程的能量图。
过程的能量图。 催化的条件下,反应可分为三个过程:
催化的条件下,反应可分为三个过程:
过程I: ;
;
过程Ⅱ:____________________ ;
过程Ⅲ: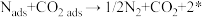 。
。
过程I为__________ 反应(填“吸热”或“放热”),整个反应的决速步为过程__________ (填“I”或“Ⅱ”或“Ⅲ”)。
②对比无 催化的过程,有催化剂
催化的过程,有催化剂 的吸附利于键的断裂
的吸附利于键的断裂__________ (填“N—O”或“C—O”),从而降低反应能垒。
(3)科研团队研究了在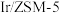 催化作用下烟气(含
催化作用下烟气(含 )中
)中 含量对
含量对 去除率的影响,结果如下图所示。
去除率的影响,结果如下图所示。 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率增大,原因是
去除率增大,原因是__________ 。
②在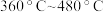 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率差别不大,可能的原因是
去除率差别不大,可能的原因是_________ 。
(4)向某恒温恒容的密闭容器内按照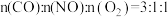 投料,若初始压强为
投料,若初始压强为 ,模拟上述脱硝反应(忽略
,模拟上述脱硝反应(忽略 变化),平衡时脱硝率达到
变化),平衡时脱硝率达到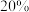 ,则脱硝反应的
,则脱硝反应的
____ (列出计算式)
 (
(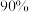 以上为
以上为 )。
)。回答下列问题:
(1)目前,
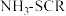 R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是:
R脱硝技术是全世界广泛使用的脱硝技术,其主要原理是: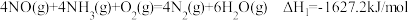
已知:
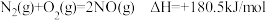 。
。写出
 被
被 直接氧化为
直接氧化为 的热化学方程式
的热化学方程式(2)对于含
 的烟气,可以直接利用
的烟气,可以直接利用 还原
还原 (
( 脱硝技术),生成
脱硝技术),生成 和
和 ,实现“以废治废”。右图为
,实现“以废治废”。右图为 还原
还原 过程的能量图。
过程的能量图。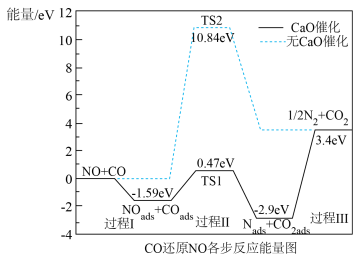
 催化的条件下,反应可分为三个过程:
催化的条件下,反应可分为三个过程:过程I:
 ;
;过程Ⅱ:
过程Ⅲ:
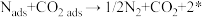 。
。过程I为
②对比无
 催化的过程,有催化剂
催化的过程,有催化剂 的吸附利于键的断裂
的吸附利于键的断裂(3)科研团队研究了在
 催化作用下烟气(含
催化作用下烟气(含 )中
)中 含量对
含量对 去除率的影响,结果如下图所示。
去除率的影响,结果如下图所示。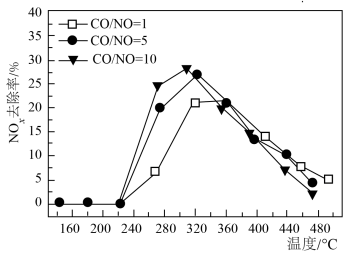
 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率增大,原因是
去除率增大,原因是②在
 的范围内,相同温度下,随着
的范围内,相同温度下,随着 与
与 比例的提高,
比例的提高, 去除率差别不大,可能的原因是
去除率差别不大,可能的原因是(4)向某恒温恒容的密闭容器内按照
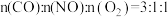 投料,若初始压强为
投料,若初始压强为 ,模拟上述脱硝反应(忽略
,模拟上述脱硝反应(忽略 变化),平衡时脱硝率达到
变化),平衡时脱硝率达到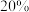 ,则脱硝反应的
,则脱硝反应的
您最近一年使用:0次
2024-03-21更新
|
220次组卷
|
2卷引用:四川省宜宾市2024届高三第二次诊断性考试理综-化学试题
解题方法
6 . 二氧化碳加氢制甲烷过程中的主要反应为
Ⅰ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
Ⅲ.2CO(g)+2H2(g)=CO2(g)+CH4(g) △H3
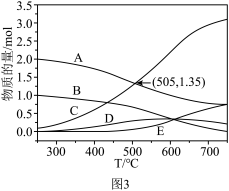
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,在催化剂作用下反应相同时间所测得的CO2平衡转化率、CO2实际转化率随温度的变化如图2所示。CH4的选择性可表示为 ×100%。
×100%。______ kJ•mol-1,平衡时CH4的选择性随着温度的升高______ ,用该催化剂催化二氧化碳反应的最佳温度为______ ,450℃时,使CO2平衡转化率达到X点的值,可以采用的措施为_______ (写出一条)。______ 。在505℃,反应Ⅱ的平衡常数K=______ 。(保留两位有效数字)______ 种价态,催化剂中掺入少量CaO,用Ca2+替代CeO2结构中部分Ce4+形成CaxCe1-xOy,可提高催化效率的原因是_______ 。
Ⅰ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
Ⅲ.2CO(g)+2H2(g)=CO2(g)+CH4(g) △H3
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:4时,在催化剂作用下反应相同时间所测得的CO2平衡转化率、CO2实际转化率随温度的变化如图2所示。CH4的选择性可表示为
 ×100%。
×100%。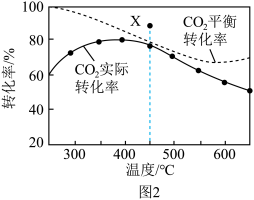

您最近一年使用:0次
2024-03-21更新
|
499次组卷
|
3卷引用:山东省济宁市2024届高三下学期一模考试化学试题
山东省济宁市2024届高三下学期一模考试化学试题(已下线)专题14 化学反应原理综合题-【好题汇编】5年(2020-2024)高考1年模拟化学真题分类汇编(山东专用)专题7 化学反应速率与化学平衡-化学反应速率及平衡计算
7 .  的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。
Ⅰ.热化学法处理 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是___________ 。
(2)该反应的正逆反应速率可分别表示为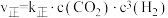 ,
,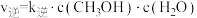 ,其中
,其中 、
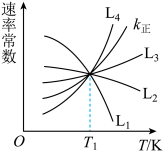
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为___________ (填“ ”“
”“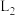 ”“
”“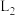 ”或“
”或“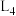 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在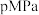 下,将
下,将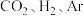 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
___________ 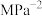 。
。
(4)实际合成反应时,也会有 等生成。在恒压条件下
等生成。在恒压条件下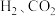 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:

①合成 最适宜的温度为
最适宜的温度为___________
②在 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是___________ 。
Ⅱ.回收利用工业废气中的 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
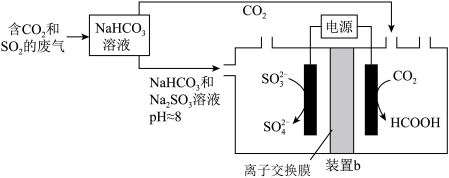
(5)反应后装置b中溶液
___________ (填“增大”、“减小”或“不变”),装置b中的总反应的离子方程式为___________ 。
 的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。Ⅰ.热化学法处理
 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是
(2)该反应的正逆反应速率可分别表示为
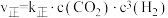 ,
,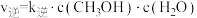 ,其中
,其中 、
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为 ”“
”“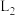 ”“
”“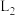 ”或“
”或“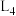 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在
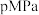 下,将
下,将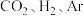 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
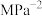 。
。(4)实际合成反应时,也会有
 等生成。在恒压条件下
等生成。在恒压条件下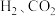 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:
①合成
 最适宜的温度为
最适宜的温度为②在
 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是Ⅱ.回收利用工业废气中的
 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
(5)反应后装置b中溶液

您最近一年使用:0次
解题方法
8 . 钴(Co)合金广泛应用于机械制造等领域。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为_____ 。
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。
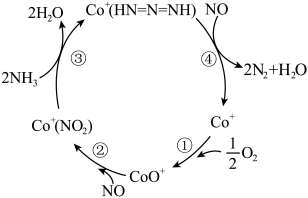
①在反应②中NO作_____ (填“氧化剂”或“还原剂”),与反应④中NO的作用_____ (填“是”或“不是”)一样的。
②写出步骤③对应的离子方程式:_____ 。
③整个历程中氧化剂与还原剂的物质的量之比为_____ 。
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:_____ 。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。

①在反应②中NO作
②写出步骤③对应的离子方程式:
③整个历程中氧化剂与还原剂的物质的量之比为
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:
您最近一年使用:0次
名校
9 . 杭州亚运会主火炬燃料是“零碳甲醇”,这是一种利用焦炉气中的 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)
_______ 。
(2)在密闭容器中充有2molCO和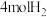 ,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积_______ (填“大于”、“=”或“小于”)2L。若反应进行1min达到平衡状态C,用CO的分压变化表示的平均反应速率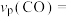
_______ 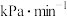 ,此时的化学平衡常数
,此时的化学平衡常数
_______ [ 是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
(3)不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
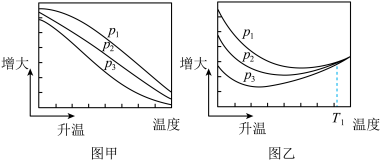
已知: 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率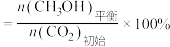
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图_______ (填“甲”或“乙”);压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ;图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是_______ 。
(4)催化还原法
① 与丙烯通过金属杂多酸盐
与丙烯通过金属杂多酸盐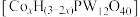 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对
催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对 转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是_______ 。
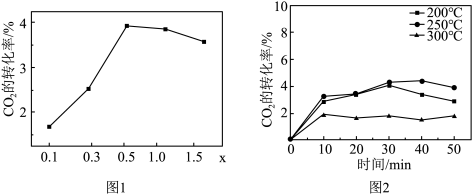
②催化剂在温度不同时对 转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因_______ 。
 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)在密闭容器中充有2molCO和
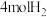 ,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应Ⅱ,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积
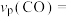
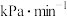 ,此时的化学平衡常数
,此时的化学平衡常数
 是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。(3)不同压强下,按照
 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率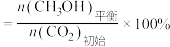
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是(4)催化还原法
①
 与丙烯通过金属杂多酸盐
与丙烯通过金属杂多酸盐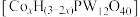 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对
催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对 转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
②催化剂在温度不同时对
 转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
转化率的影响如图2所示,300℃催化效果远不如200℃和250℃的原因
您最近一年使用:0次
名校
10 . 研究 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
I.
II.
(1)一定条件下,速率常数与活化能、温度的关系式为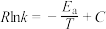 (R、C为常数,k为速率常数,
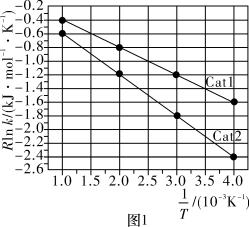
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
在Cat2作用下,该反应的活化能 为
为___________  ;催化效果更好的是
;催化效果更好的是___________ (填“Cat1”或“Cat2”)。
(2) 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
若反应I、II均达到平衡时, ;则表中
;则表中
___________ ; 内,
内, 的分压变化率为
的分压变化率为___________  ;反应I的平衡常数
;反应I的平衡常数
___________  。
。
(3) 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:
主反应:
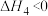
副反应:

若将 和
和 按体积比为
按体积比为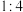 混合(
混合(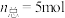 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
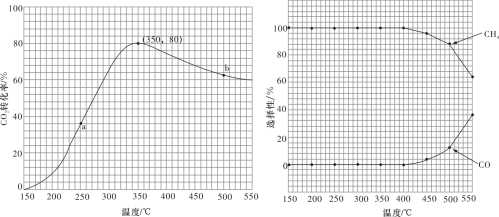
①a点的正反应速率和逆反应速率的大小关系为
___________ (填“>”“=”或“<”) 。
。
②催化剂在较低温度时主要选择___________ (填“主反应”或“副反应”)。
③350~400℃时; 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是___________ 。
 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:I.

II.

(1)一定条件下,速率常数与活化能、温度的关系式为
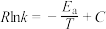 (R、C为常数,k为速率常数,
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。在Cat2作用下,该反应的活化能
 为
为 ;催化效果更好的是
;催化效果更好的是
(2)
 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:| 物质的量/mol | 总压强/kPa | |||||
 |  |  | CO |  | ||
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 |  |
| 平衡 | n | 0.3 | p | |||
 ;则表中
;则表中
 内,
内, 的分压变化率为
的分压变化率为 ;反应I的平衡常数
;反应I的平衡常数
 。
。(3)
 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:主反应:

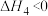
副反应:


若将
 和
和 按体积比为
按体积比为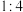 混合(
混合(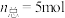 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
①a点的正反应速率和逆反应速率的大小关系为

 。
。②催化剂在较低温度时主要选择
③350~400℃时;
 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是
您最近一年使用:0次







