名校
1 . 某化学兴趣小组阅读课外资料得知:过氧化氢制氧气除了二氧化锰为催化剂,还可以用氧化铜、马铃薯、铁锈、红砖粉末等物质作为催化剂,于是他们想检验生活中马铃薯是否能作为过氧化氢分解的催化剂。
【提出问题】马铃薯是否能作为过氧化氢分解的催化剂?
【查阅资料】马铃薯中含有过氧化氢酶,过氧化氢酶对过氧化氢的分解起催化剂作用。
【设计实验】化学兴趣小组的同学设计了一系列实验:
(1)设计实验Ⅰ的目的是___________ 。
(2)实验Ⅲ的实验现象是___________ 。
(3)要得出马铃薯可以作为过氧化氢分解的催化剂,还需要做的一步实验是___________ 。
(4)化学兴趣小组还想比较马铃薯和二氧化锰的催化效果,他们又设计了如下实验:
实验Ⅳ和Ⅴ中的待测数据测定除了该方法,还可使用的方法是___________ 。
【得出结论】
(5)___________ 。
【反思交流】
(6)影响上述反应的化学反应速率除了催化剂外,还可能有温度、反应物的浓度等,请选择其中一项用文字叙述一个操作方案来证明:___________ 。
【提出问题】马铃薯是否能作为过氧化氢分解的催化剂?
【查阅资料】马铃薯中含有过氧化氢酶,过氧化氢酶对过氧化氢的分解起催化剂作用。
【设计实验】化学兴趣小组的同学设计了一系列实验:
| 实验 | 实验步骤 | 实验现象 |
| Ⅰ | 取5%的过氧化氢溶液5mL,用带火星的木条伸入试管口 | |
| Ⅱ | 取5%的过氧化氢溶液5mL,加入0.5g马铃薯(切成豆粒大小),用带火星的木条伸入试管口 | 木条复燃 |
| Ⅲ | 待实验Ⅱ中没有气泡放出后,继续加入5%的过氧化氢溶液,用带火星的木条伸入试管口 |
(2)实验Ⅲ的实验现象是
(3)要得出马铃薯可以作为过氧化氢分解的催化剂,还需要做的一步实验是
(4)化学兴趣小组还想比较马铃薯和二氧化锰的催化效果,他们又设计了如下实验:
| 实验 | 5%的过氧化氢溶液 | 催化剂 | 待测数据(排水法收集100mL氧气所需时间) | |
| Ⅳ | 15mL | 二氧化锰0.5g | x秒 | 测得x>y |
| Ⅴ | 15mL | 马铃薯0.5g | y秒 | |
【得出结论】
(5)
【反思交流】
(6)影响上述反应的化学反应速率除了催化剂外,还可能有温度、反应物的浓度等,请选择其中一项用文字叙述一个操作方案来证明:
您最近一年使用:0次
名校
解题方法
2 . 1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。图1是哈伯法的流程图,图2是反应历程。

(1)写出合成 的热化学方程式
的热化学方程式_______ 。已知该反应的 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
_______ kJ⋅mol 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因_______ 。
(2)步骤③采用的催化剂是_______ ,使用催化剂后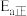
_______ (填“增大”、“减小”或“不变”,下同),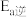
_______ 。
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
(4)500℃、20MPa时,将 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:

①反应开始到第10 min, 的平均反应速率为
的平均反应速率为_______ mol-1⋅L-1⋅min-1。
②反应进行到10 min至20 min时改变的条件可能是_______ 。
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了
③在25min改变条件后,平衡_______ (填“正”或“逆”)向移动,达到新平衡后 的体积分数比原平衡
的体积分数比原平衡_______ (填“大”或“小”)。

(1)写出合成
 的热化学方程式
的热化学方程式 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因(2)步骤③采用的催化剂是
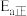
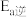
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:
①反应开始到第10 min,
 的平均反应速率为
的平均反应速率为②反应进行到10 min至20 min时改变的条件可能是
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了

③在25min改变条件后,平衡
 的体积分数比原平衡
的体积分数比原平衡
您最近一年使用:0次
2023-04-03更新
|
270次组卷
|
2卷引用:上海交通大学附属中学2022-2023学年高二下学期开学摸底考化学试题
名校
3 . 直接甲烷化是将煤粉颗粒、催化剂与水蒸气在一个反应器中同时发生煤气化反应(反应Ⅰ、反应Ⅱ)和甲烷化反应(反应III):
反应I:
 kJ/mol;
kJ/mol;
反应II:
 kJ/mol;
kJ/mol;
反应III: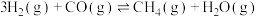
 kJ/mol。
kJ/mol。
已知:煤直接甲烷化中反应器出口气体主要为 、CO、
、CO、 、
、 ,
, 的含量很低可以忽略。
的含量很低可以忽略。
回答下列问题:
(1)煤直接甲烷化(方法1)的总反应可表示为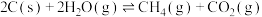
______ kJ/mol。另一种煤的甲烷化的方法(方法2)是将煤粉颗粒与氢气混合,在金属钌的催化作用下直接合成甲烷,该反应的热化学方程式为______ 。方法2与方法1相比优点是______ (任写一条)。
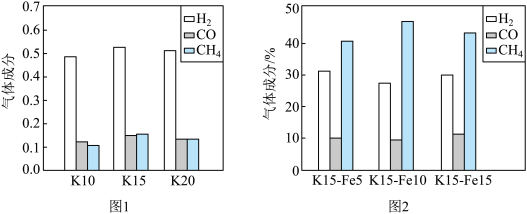
(2)在KOH含量不同的三种催化剂(K10、K15、K20)作用下,出口气体中各气体含量与催化剂的关系如图1所示。若固定KOH含量并加入不同含量的铁形成复合催化剂(K15-Fe5、K15-Fe10、K15-Fe15),出口气体中各气体含量与催化剂的关系如图2所示。从甲烷化的目的来看,六种催化剂中催化效果最好的是______ ,对甲烷化反应选择性较高的催化剂是______ (填“KOH”或“Fe”)。
(3)若恒温、恒容的密闭容器中加入3 mol 和1 mol CO发生反应I,下列选项能说明体系达到平衡状态的是______。
和1 mol CO发生反应I,下列选项能说明体系达到平衡状态的是______。
(4)若在一个恒温(T℃)、恒压(p kPa)的密闭容器中加入5 mol C和3.6 mol  ,只发生反应I、反应III,经过20 min达到平衡状态,此时碳转化率
,只发生反应I、反应III,经过20 min达到平衡状态,此时碳转化率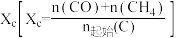 为60%,氢气的物质的量为0.6 mol。
为60%,氢气的物质的量为0.6 mol。
①0~20min内反应III的平均反应速率
______ kPa/min;
②T℃时反应I的平衡常数
______ (用某组分B的平衡压强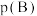 代替物质的量浓度c(B)也可表示平衡常数,记作
代替物质的量浓度c(B)也可表示平衡常数,记作 ,如
,如 ,p为平衡总压强,
,p为平衡总压强,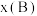 为平衡系统中B的物质的量分数)。
为平衡系统中B的物质的量分数)。
反应I:

 kJ/mol;
kJ/mol;反应II:

 kJ/mol;
kJ/mol;反应III:
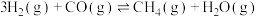
 kJ/mol。
kJ/mol。已知:煤直接甲烷化中反应器出口气体主要为
 、CO、
、CO、 、
、 ,
, 的含量很低可以忽略。
的含量很低可以忽略。回答下列问题:
(1)煤直接甲烷化(方法1)的总反应可表示为
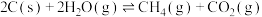
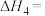
(2)在KOH含量不同的三种催化剂(K10、K15、K20)作用下,出口气体中各气体含量与催化剂的关系如图1所示。若固定KOH含量并加入不同含量的铁形成复合催化剂(K15-Fe5、K15-Fe10、K15-Fe15),出口气体中各气体含量与催化剂的关系如图2所示。从甲烷化的目的来看,六种催化剂中催化效果最好的是

(3)若恒温、恒容的密闭容器中加入3 mol
 和1 mol CO发生反应I,下列选项能说明体系达到平衡状态的是______。
和1 mol CO发生反应I,下列选项能说明体系达到平衡状态的是______。| A.容器中的压强不再改变 |
B. H,和CO的物质的量之比不再改变 H,和CO的物质的量之比不再改变 |
C. 和CO的物质的量之比不再改变 和CO的物质的量之比不再改变 |
D. 和CO的总物质的量不再改变 和CO的总物质的量不再改变 |
 ,只发生反应I、反应III,经过20 min达到平衡状态,此时碳转化率
,只发生反应I、反应III,经过20 min达到平衡状态,此时碳转化率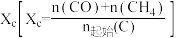 为60%,氢气的物质的量为0.6 mol。
为60%,氢气的物质的量为0.6 mol。①0~20min内反应III的平均反应速率

②T℃时反应I的平衡常数

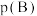 代替物质的量浓度c(B)也可表示平衡常数,记作
代替物质的量浓度c(B)也可表示平衡常数,记作 ,如
,如 ,p为平衡总压强,
,p为平衡总压强,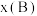 为平衡系统中B的物质的量分数)。
为平衡系统中B的物质的量分数)。
您最近一年使用:0次
2023-02-16更新
|
216次组卷
|
3卷引用: 上海交通大学附属中学2022-2023学年高三下学期开学摸底考试化学试题



