名校
1 . 亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业,是一种浅黄色、遇水易分解的固体,但溶于浓硫酸后并不分解。某实验小组将在A中产生的SO2通入浓硫酸和浓硝酸的混合溶液中制备亚硝酰硫酸,并测定产品的纯度。
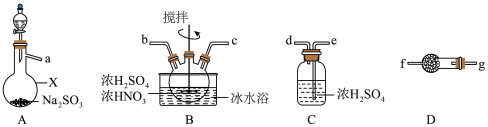
(1)仪器X的名称为___________ ;
(2)按气流从左到右的顺序,上述仪器的连接顺序为(填仪器接口字母)___________ 。
(3)①装置B中发生反应的化学方程式为___________ 。
②开始时反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其可能原因是___________ 。
(4)装置B中维持反应体系温度不高于20℃的主要原因是___________ 。
(5)测定产品的纯度:称取4.5g产品放入锥形瓶中,加入100.00 mL 0.10mol/L的KMnO4溶液和适量H2SO4,摇匀,再将溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,然后用0.20 mol/L的Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为25.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+10CO2+5Na2SO4+8H2O。
①滴定终点的现象为___________ 。
②该产品的纯度为___________ % (保留小数点后一位)。

(1)仪器X的名称为
(2)按气流从左到右的顺序,上述仪器的连接顺序为(填仪器接口字母)
(3)①装置B中发生反应的化学方程式为
②开始时反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其可能原因是
(4)装置B中维持反应体系温度不高于20℃的主要原因是
(5)测定产品的纯度:称取4.5g产品放入锥形瓶中,加入100.00 mL 0.10mol/L的KMnO4溶液和适量H2SO4,摇匀,再将溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,然后用0.20 mol/L的Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为25.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+10CO2+5Na2SO4+8H2O。
①滴定终点的现象为
②该产品的纯度为
您最近一年使用:0次
2 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。
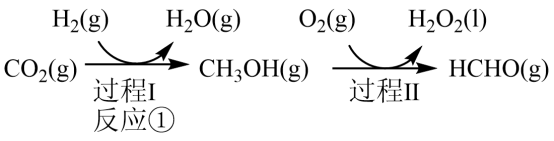
已知:
反应②:
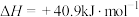 ;
;
反应③:
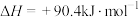 。
。
(1)反应①的热化学方程式为_______ ;若过程II中 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成_______ mol HCHO。
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
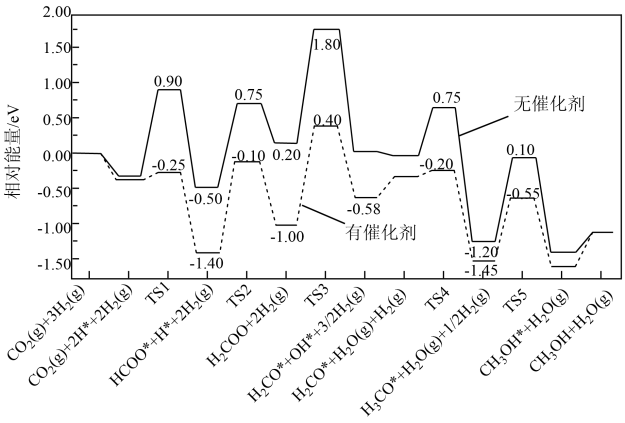
该反应历程中决速步骤的化学方程式为_______ ,催化剂使该步骤的活化能降低_______ eV。
(3)某研究小组采用上述催化剂,向密闭容器中通入 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。

i.下列说法正确的是_______ (填标号)。
A.曲线a为等压线,曲线b为等温线
B.增大 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大
C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中 为
为 ,CO为
,CO为 ,则此时
,则此时 的分压为
的分压为_______ kPa,反应①的压强平衡常数
_______  (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
iii.图中M点的 高于N点的原因是
高于N点的原因是_______ 。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。
已知:
反应②:

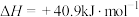 ;
;反应③:

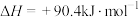 。
。(1)反应①的热化学方程式为
 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中决速步骤的化学方程式为
(3)某研究小组采用上述催化剂,向密闭容器中通入
 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。
i.下列说法正确的是
A.曲线a为等压线,曲线b为等温线
B.增大
 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中
 为
为 ,CO为
,CO为 ,则此时
,则此时 的分压为
的分压为
 (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。iii.图中M点的
 高于N点的原因是
高于N点的原因是
您最近一年使用:0次
2022-03-31更新
|
999次组卷
|
4卷引用:福建省永春第一中学2023届高三下学期期初考试化学试题
福建省永春第一中学2023届高三下学期期初考试化学试题广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)押广东卷化学第19题 化学反应原理综合题-备战2022年高考化学临考题号押题(广东卷)
名校
3 . I.工业上H2O2是一种重要的绿色氧化还原试剂,某小组对 的催化分解实验进行探究。在同浓度
的催化分解实验进行探究。在同浓度 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。实验装置如图所示:
分解反应速率的影响。实验装置如图所示:

(1)写出 溶液在
溶液在 催化下分解的化学方程式
催化下分解的化学方程式_______ ;除了图中所示仪器之外,该实验还必需的仪器是_______ 。
(2)请写出下面表格中Ⅰ、Ⅱ、Ⅲ的实验记录内容或数据:
Ⅰ=_______ ,Ⅱ=_______ ,Ⅲ=_______ 。
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,并同时制得 和NaOH溶液.相关物料的传输与转化关系如图所示:
和NaOH溶液.相关物料的传输与转化关系如图所示:

请回答下列问题:
(3)A池总反应的离子反应方程式为_______ .燃料电池B中正负电极上发生反应分别为_______ ;_______ 。
(4)装置中的离子膜是阳离子交换膜,当阴极产生1molY时,A中通过离子交换膜的 有
有_______ mol。
(5)装置图中氢氧化钠溶液质量分数的大小:a%_______ b%(填“>”、“=”或“<”)。
 的催化分解实验进行探究。在同浓度
的催化分解实验进行探究。在同浓度 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。实验装置如图所示:
分解反应速率的影响。实验装置如图所示:
(1)写出
 溶液在
溶液在 催化下分解的化学方程式
催化下分解的化学方程式(2)请写出下面表格中Ⅰ、Ⅱ、Ⅲ的实验记录内容或数据:
| 实验序号 |  溶液的的体积/mL 溶液的的体积/mL | Ⅱ | 30% 溶液的体积/mL 溶液的体积/mL | 蒸馏水的体积/mL |  的体积/mL 的体积/mL |
| 1 | Ⅰ | b | c | d | e |
| 2 | a | b | d | Ⅲ | f |
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,并同时制得
 和NaOH溶液.相关物料的传输与转化关系如图所示:
和NaOH溶液.相关物料的传输与转化关系如图所示:
请回答下列问题:
(3)A池总反应的离子反应方程式为
(4)装置中的离子膜是阳离子交换膜,当阴极产生1molY时,A中通过离子交换膜的
 有
有(5)装置图中氢氧化钠溶液质量分数的大小:a%
您最近一年使用:0次
4 . 发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________ ;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。
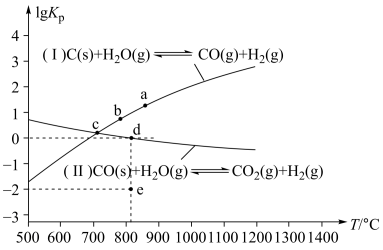
①反应(I)的△H______ 0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________ ;此时CO的转化率为________ ;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的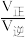 =
=______ ;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________ (填数值)。
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率
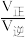 =
=③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为
您最近一年使用:0次
2020-06-19更新
|
299次组卷
|
3卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题
名校
解题方法
5 . 一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:

(1)二甲醚的合成反应:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H1
CH3OCH3(g)+CO2(g) △H1
①已知CO、H2与CH3OCH3的燃烧热(△H)分别为akJ/mol、bkJ/mol、ckJ/mol (a、b、c均小于0),则△H1=____ kJ/mol。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______ (填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s) CO(g)+2H2(g)+3FeO(s)
CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s) CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如右下图。

①随着压强的增大,反应i的平衡常数K值____ (填“增大”、“减小”或“不变”)。
②结合图象,分析H2O的体积分数变化的原因_________ (用化学方程式表示)。
(3)将一定量的FeO和CO2 置于CO2 还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g) +3FeO(s) Fe3O4(s) +CO(g) △H2
Fe3O4(s) +CO(g) △H2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
①△H2_____ 0(填“>”或“<”)。
②若在150 ℃时进行上述转化,理论转化率α(FeO)=______ 。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是_____ (填标号)。
A.体系的压强不变 B. CO2 的 物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2 还原器温度设置在170 ℃的原因_________ 。

(1)二甲醚的合成反应:3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H1
CH3OCH3(g)+CO2(g) △H1①已知CO、H2与CH3OCH3的燃烧热(△H)分别为akJ/mol、bkJ/mol、ckJ/mol (a、b、c均小于0),则△H1=
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)
 CO(g)+2H2(g)+3FeO(s)
CO(g)+2H2(g)+3FeO(s)ii.CH4(g)+4Fe3O4(s)
 CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如右下图。

①随着压强的增大,反应i的平衡常数K值
②结合图象,分析H2O的体积分数变化的原因
(3)将一定量的FeO和CO2 置于CO2 还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g) +3FeO(s)
 Fe3O4(s) +CO(g) △H2
Fe3O4(s) +CO(g) △H2保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
| 温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
| CO2 体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
| CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2
②若在150 ℃时进行上述转化,理论转化率α(FeO)=
③在上述反应体系中,一定可以说明该反应达到平衡状态的是
A.体系的压强不变 B. CO2 的 物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2 还原器温度设置在170 ℃的原因
您最近一年使用:0次
2017-03-23更新
|
578次组卷
|
2卷引用:福建省厦门外国语学校2018届高三下学期第一次(开学)考试理综化学试题



