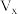名校
解题方法
1 . 二氧化碳资源化利用是科研的热点, 甲烷化技术是重要途径之一,其相关反应如下:
甲烷化技术是重要途径之一,其相关反应如下:
ⅰ.
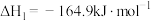
ⅱ.
 ;
;
ⅲ.积炭反应: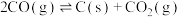
 ;
;
ⅳ.
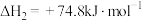 。
。
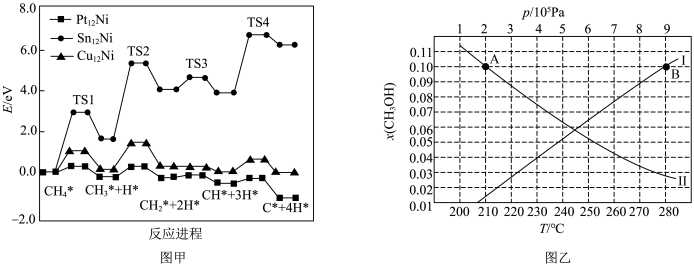
(1)CO歧化积炭反应在低温下能自发进行,则
______ 0(填“>”或“<”)。
(2)研究表明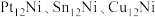 三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中
三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中 在不同催化剂作用下裂解的反应历程如图甲所示。
在不同催化剂作用下裂解的反应历程如图甲所示。
①该历程分______ 步进行,甲烷逐步脱氢过程中活化能最大的反应步骤是:______ (用化学方程式表示)。
② 双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:
双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:______ 。
(3) 加氢制甲醇也是
加氢制甲醇也是 资源化利用的重要途径之一,其反应原理为
资源化利用的重要途径之一,其反应原理为
 。投料比
。投料比 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 时
时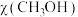 随压强
随压强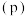 变化关系及在
变化关系及在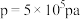 时
时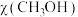 随温度(
随温度( )的曲线变化如图乙所示:
)的曲线变化如图乙所示:
①图中对应等温过程的曲线为______ 。
②图中 两点的速率
两点的速率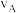
______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③当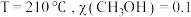 时,
时, 的平衡转化率为
的平衡转化率为______ ; 为210℃时,各物质的平衡分压表示反应的平衡常数
为210℃时,各物质的平衡分压表示反应的平衡常数
______ (列出计算式)。
 甲烷化技术是重要途径之一,其相关反应如下:
甲烷化技术是重要途径之一,其相关反应如下:ⅰ.

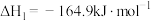
ⅱ.

 ;
;ⅲ.积炭反应:
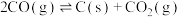
 ;
;ⅳ.

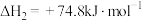 。
。
(1)CO歧化积炭反应在低温下能自发进行,则

(2)研究表明
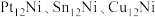 三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中
三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中 在不同催化剂作用下裂解的反应历程如图甲所示。
在不同催化剂作用下裂解的反应历程如图甲所示。①该历程分
②
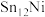 双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:
双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:(3)
 加氢制甲醇也是
加氢制甲醇也是 资源化利用的重要途径之一,其反应原理为
资源化利用的重要途径之一,其反应原理为
 。投料比
。投料比 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为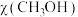 ,在
,在 时
时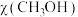 随压强
随压强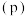 变化关系及在
变化关系及在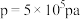 时
时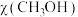 随温度(
随温度( )的曲线变化如图乙所示:
)的曲线变化如图乙所示:①图中对应等温过程的曲线为
②图中
 两点的速率
两点的速率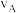
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③当
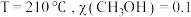 时,
时, 的平衡转化率为
的平衡转化率为 为210℃时,各物质的平衡分压表示反应的平衡常数
为210℃时,各物质的平衡分压表示反应的平衡常数
您最近一年使用:0次
名校
2 . 甲醇 属于基础化工原料,在化学工业中占有重要地位。回答下列问题:
属于基础化工原料,在化学工业中占有重要地位。回答下列问题:
(1)工业上制备甲醇的热化学方程式为
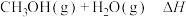 。已知
。已知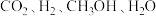 的能量依次为
的能量依次为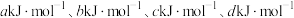 ,则
,则
___________  。将物质的量之比1:3的
。将物质的量之比1:3的 和
和 以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得
以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得 的转化率随温度变化的关系如图1所示:使
的转化率随温度变化的关系如图1所示:使 的转化率最好的催化剂是
的转化率最好的催化剂是___________ (填“Cat-a”或“Cat-b”),与另一催化剂相比,使用该催化剂存在的㢣端是___________ 。 ,反应为
,反应为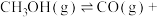
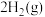 。起始时,向某刚性容器中通入一定量的
。起始时,向某刚性容器中通入一定量的 ,平衡时各物质的物质的量与温度的关系如图2所示。
,平衡时各物质的物质的量与温度的关系如图2所示。___________ (填化学式)。
②A点处体系中 的体积分数为
的体积分数为___________ 。
③ 点处,若容器的压强为
点处,若容器的压强为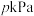 ,则
,则 点处
点处 的转化率为
的转化率为___________ ,此温度下该反应的平衡常数
___________  (用平衡压强代替平衡浓度,分压=总压
(用平衡压强代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
(3)甲醇可催化制备丙烯,反应为 ,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为
,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为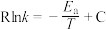 (其中
(其中 为活化能,
为活化能, 为速率常数,只与温度有关,
为速率常数,只与温度有关, 和C为常数)。
和C为常数)。
___________  。
。
②当使用更高效催化剂时,实验数据变成图3中的曲线___________ (填图3“b”或“c”)。
 属于基础化工原料,在化学工业中占有重要地位。回答下列问题:
属于基础化工原料,在化学工业中占有重要地位。回答下列问题:(1)工业上制备甲醇的热化学方程式为

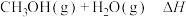 。已知
。已知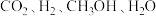 的能量依次为
的能量依次为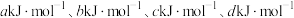 ,则
,则
 。将物质的量之比1:3的
。将物质的量之比1:3的 和
和 以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得
以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得 的转化率随温度变化的关系如图1所示:使
的转化率随温度变化的关系如图1所示:使 的转化率最好的催化剂是
的转化率最好的催化剂是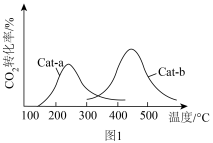
 ,反应为
,反应为
 。起始时,向某刚性容器中通入一定量的
。起始时,向某刚性容器中通入一定量的 ,平衡时各物质的物质的量与温度的关系如图2所示。
,平衡时各物质的物质的量与温度的关系如图2所示。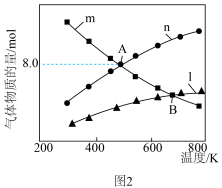
②A点处体系中
 的体积分数为
的体积分数为③
 点处,若容器的压强为
点处,若容器的压强为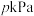 ,则
,则 点处
点处 的转化率为
的转化率为
 (用平衡压强代替平衡浓度,分压=总压
(用平衡压强代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。(3)甲醇可催化制备丙烯,反应为
 ,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为
,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为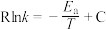 (其中
(其中 为活化能,
为活化能, 为速率常数,只与温度有关,
为速率常数,只与温度有关, 和C为常数)。
和C为常数)。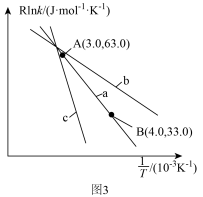

 。
。②当使用更高效催化剂时,实验数据变成图3中的曲线
您最近一年使用:0次
2024-02-23更新
|
249次组卷
|
5卷引用:四川省绵阳中学2023-2024学年高三下学期2月开学考理科综合-高中化学
名校
解题方法
3 . 苯乙烯是重要的有机化工原料,可用乙苯为原料制备苯乙烯。制备方法有直接脱氢法和氧化脱氢法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接脱氢:
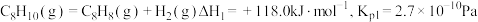
(ⅱ)氧化脱氢:

回答下列问题:
(1)①反应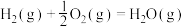 的
的
_______  ,平衡常数
,平衡常数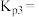
_______ (用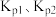 表示)。
表示)。
②氧化脱氢的反应趋势远大于直接脱氢,其原因是_______ 。
③提高氧化脱氢反应平衡转化率的措施有_______ 、_______ 。
(2)已知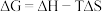 ,忽略
,忽略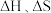 随温度的变化。当
随温度的变化。当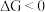 时,反应能自发进行。在
时,反应能自发进行。在 下,直接脱氢反应的
下,直接脱氢反应的 和
和 随温度变化的理论计算结果如图所示。
随温度变化的理论计算结果如图所示。

①直接脱氢反应在常温下_______ (选填“能”或“不能”)自发。
② 随温度的变化曲线为
随温度的变化曲线为_______ (选填“a”或“b”),判断的理由是_______ 。
③在某温度、 下,向密闭容器中通入
下,向密闭容器中通入 气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数
气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数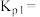
_______  (保留小数点后一位;分压
(保留小数点后一位;分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)乙苯脱氢制苯乙烯往往伴随副反应,生成苯和甲苯等芳香烃副产物。一定温度和压强条件下,为了提高反应速率和苯乙烯选择性,应当_______ 。
 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:(ⅰ)直接脱氢:
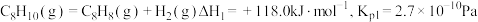
(ⅱ)氧化脱氢:

回答下列问题:
(1)①反应
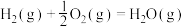 的
的
 ,平衡常数
,平衡常数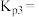
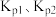 表示)。
表示)。②氧化脱氢的反应趋势远大于直接脱氢,其原因是
③提高氧化脱氢反应平衡转化率的措施有
(2)已知
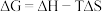 ,忽略
,忽略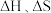 随温度的变化。当
随温度的变化。当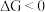 时,反应能自发进行。在
时,反应能自发进行。在 下,直接脱氢反应的
下,直接脱氢反应的 和
和 随温度变化的理论计算结果如图所示。
随温度变化的理论计算结果如图所示。
①直接脱氢反应在常温下
②
 随温度的变化曲线为
随温度的变化曲线为③在某温度、
 下,向密闭容器中通入
下,向密闭容器中通入 气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数
气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数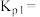
 (保留小数点后一位;分压
(保留小数点后一位;分压 总压
总压 物质的量分数)。
物质的量分数)。(3)乙苯脱氢制苯乙烯往往伴随副反应,生成苯和甲苯等芳香烃副产物。一定温度和压强条件下,为了提高反应速率和苯乙烯选择性,应当
您最近一年使用:0次
2024-01-22更新
|
807次组卷
|
7卷引用:四川省遂宁市射洪市四川省射洪中学校2023-2024学年高三下学期开学理综试题-高中化学
四川省遂宁市射洪市四川省射洪中学校2023-2024学年高三下学期开学理综试题-高中化学2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)T29-原理综合题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)T17-原理综合题(已下线)T16-原理综合题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
4 . 研究气体的制备和性质有重要意义。某兴趣小组分别对 和
和 的制备进行研究,回答下列问题。
的制备进行研究,回答下列问题。
Ⅰ.氨气的制备

(1)盛装碱石灰的仪器的名称_______ 。
(2)实验室用加热 和
和 固体混合物制备氨气,化学方程式为
固体混合物制备氨气,化学方程式为_______ 。
(3)收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:
_______  尾气处理(按气流方向表示)。
尾气处理(按气流方向表示)。
(4)检验集气瓶已收集满氨的方法:用_______ ,靠近集气瓶口,若出现_______ ,则说明收集满。
Ⅱ. 分解制备
分解制备
(5)探究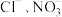 对
对 分解的影响
分解的影响
设计如图实验装置,在试管中分别添加了如下表的试剂和用量,再分别注入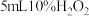 溶液,实验设计如下:
溶液,实验设计如下:

①实验结果显示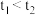 ,可得出的结论是:
,可得出的结论是:_______ (填化学式)更有利于 分解。
分解。
②甲同学查阅资料得知: 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学再进行实验:向两份
干扰,该同学再进行实验:向两份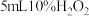 溶液中分别加入
溶液中分别加入 浓度均为
浓度均为_______  的
的_______ (填化学式)溶液和_______ (填化学式)溶液。 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下,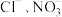 对
对 催化分解无影响。
催化分解无影响。
 和
和 的制备进行研究,回答下列问题。
的制备进行研究,回答下列问题。Ⅰ.氨气的制备

(1)盛装碱石灰的仪器的名称
(2)实验室用加热
 和
和 固体混合物制备氨气,化学方程式为
固体混合物制备氨气,化学方程式为(3)收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:

 尾气处理(按气流方向表示)。
尾气处理(按气流方向表示)。(4)检验集气瓶已收集满氨的方法:用
Ⅱ.
 分解制备
分解制备
(5)探究
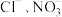 对
对 分解的影响
分解的影响设计如图实验装置,在试管中分别添加了如下表的试剂和用量,再分别注入
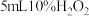 溶液,实验设计如下:
溶液,实验设计如下:
| 实验 | 添加试剂及用量 |  完全分解所需时间 完全分解所需时间 |
| 1 | 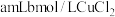 溶液 溶液 |  |
| 2 | 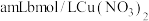 溶液 溶液 |  |
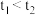 ,可得出的结论是:
,可得出的结论是: 分解。
分解。②甲同学查阅资料得知:
 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学再进行实验:向两份
干扰,该同学再进行实验:向两份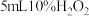 溶液中分别加入
溶液中分别加入 浓度均为
浓度均为 的
的 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下,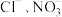 对
对 催化分解无影响。
催化分解无影响。
您最近一年使用:0次
2023-07-12更新
|
284次组卷
|
4卷引用:四川省泸县第一中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
5 . 某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
(1)写出高锰酸钾与草酸反应的离子方程式:_______ 。
(2)由实验Ⅰ、Ⅱ可得出的结论是_______ 。
(3)关于实验Ⅱ中3 min后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。
提供的试剂:0.01 mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
补全实验Ⅲ的操作:向试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加10滴3mol/L硫酸,_______ ,最后加入1 mL0.1 mol/L草酸溶液。
(4)该小组拟采用如下图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。经测定乙试管溶液褪色的时间比甲试管长,得出结论:浓度越大,反应速率越慢。你认为他们的实验方案_______ (填“合理”或“不合理”),理由是_______ 。

| 编号 | 实验操作 | 实验现象 |
| Ⅰ | 向一支试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
| Ⅱ | 向另一支试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1 mL0.1 mol/L草酸溶液 | 1 min内溶液紫色无明显变化,后颜色迅速变浅,约3 min后几乎变为无色 |
(2)由实验Ⅰ、Ⅱ可得出的结论是
(3)关于实验Ⅱ中3 min后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。
提供的试剂:0.01 mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
补全实验Ⅲ的操作:向试管中先加入1 mL0.01 mol/L酸性KMnO4溶液,再加10滴3mol/L硫酸,
(4)该小组拟采用如下图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。经测定乙试管溶液褪色的时间比甲试管长,得出结论:浓度越大,反应速率越慢。你认为他们的实验方案

您最近一年使用:0次
6 . 甲烷和二氧化碳都是温室气体。随着石油资源日益枯竭,储量丰富的甲烷(天然气、页岩气、可燃冰的主要成分)及二氧化碳的高效利用已成为科学研究的热点。回答下列问题:
(1)在催化剂作用下,将甲烷部分氧化制备合成气(CO和H2)的反应为CH4(g)+ O2(g) =CO(g)+2H2(g)。
O2(g) =CO(g)+2H2(g)。
①已知:25℃,101 kPa,由稳定单质生成1mol化合物的焓变称为该化合物的标准摩尔生成焓。化学反应的反应热ΔH=生成物的标准摩尔生成焓总和-反应物的标准摩尔生成焓总和。相关数据如下表:
由此计算CH4(g)+ O2(g) =CO(g)+2H2(g)的∆H=
O2(g) =CO(g)+2H2(g)的∆H=_______ kJ·mol-1。
②催化剂能显著提高上述反应的速率,但不能改变下列中的_______ (填标号)。
a.反应的活化能 b.活化分子百分数 c.化学平衡常数 d.反应热(ΔH)
③T℃,向VL密闭容器中充入1 mol CH4和0.5 mol O2,在催化作用下发生上述反应,达到平衡时CO的物质的量为0.9 mol,平衡常数K=_______ (列出计算式即可,不必化简)。
④欲提高甲烷的平衡转化率,可采取的两条措施是_______ 。
(2)甲烷和二氧化碳催化重整制备合成气的反应为CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH>0。我国学者通过计算机模拟对该反应进行理论研究,提出在Pt-Ni合金或Sn-Ni合金催化下,以甲烷逐级脱氢开始产生的能量称为吸附能)。脱氢阶段的反应历程如下图所示(*表示吸附在催化剂表面,吸附过程产生的能量称为吸附能)。

该历程中最大能垒(活化能)E正=_______ eV·mol-1;两种催化剂比较,脱氢反应阶段催化效果更好的是_______ 合金。
(1)在催化剂作用下,将甲烷部分氧化制备合成气(CO和H2)的反应为CH4(g)+
 O2(g) =CO(g)+2H2(g)。
O2(g) =CO(g)+2H2(g)。 ①已知:25℃,101 kPa,由稳定单质生成1mol化合物的焓变称为该化合物的标准摩尔生成焓。化学反应的反应热ΔH=生成物的标准摩尔生成焓总和-反应物的标准摩尔生成焓总和。相关数据如下表:
| 物质 | CH4 | O2 | CO | H2 |
| 标准摩尔生成焓/kJ∙mol-1 | -74.8 | 0 | -110.5 | 0 |
 O2(g) =CO(g)+2H2(g)的∆H=
O2(g) =CO(g)+2H2(g)的∆H=②催化剂能显著提高上述反应的速率,但不能改变下列中的
a.反应的活化能 b.活化分子百分数 c.化学平衡常数 d.反应热(ΔH)
③T℃,向VL密闭容器中充入1 mol CH4和0.5 mol O2,在催化作用下发生上述反应,达到平衡时CO的物质的量为0.9 mol,平衡常数K=
④欲提高甲烷的平衡转化率,可采取的两条措施是
(2)甲烷和二氧化碳催化重整制备合成气的反应为CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH>0。我国学者通过计算机模拟对该反应进行理论研究,提出在Pt-Ni合金或Sn-Ni合金催化下,以甲烷逐级脱氢开始产生的能量称为吸附能)。脱氢阶段的反应历程如下图所示(*表示吸附在催化剂表面,吸附过程产生的能量称为吸附能)。

该历程中最大能垒(活化能)E正=
您最近一年使用:0次
2022-08-03更新
|
498次组卷
|
3卷引用:四川省兴文第二中学校2023-2024学年高三上学期开学考试理综化学试题
四川省兴文第二中学校2023-2024学年高三上学期开学考试理综化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题
7 . 碳及其化合物与人类工农业生产、生活紧密相关。如甲醇就是一种重要的化工原料。
(1)已知:①CH3OH(l)+ O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=- 566.0 kJ·mol-1
则反应③CH3OH(1)+O2(g) CO(g)+2H2O(g)的ΔH=
CO(g)+2H2O(g)的ΔH=________________ 。
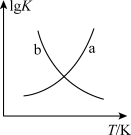
(2)图中能正确表示反应③的平衡常数的对数(lgK)随着温度(T)变化的曲线是_____________ (填“a”或“b”)。
(3)不同催化剂对CO和H2生成CH3OH的效果比较如下表所示:
①结合上表信息综合考虑,建议目前最好选择____________ 作催化剂。一般来说,催化剂的活性越好,表示使反应活化能降低得越____________ (填“多”或“少”),反应速率越____________ (填“快”或“慢”);
②选择催化剂无须考虑的因素是____________ (填正确答案标号)
A.更长的使用寿命
B.在延长使用期间有更高的平衡转化率
C.较高的活性和优越的选择性,副产物少
D.在较大的合成气组成范围内的操作弹性
E.对硫敏感(易与杂质气体中的硫元素结合)
(4)某实验室控制CO和H2的初始投料比为1:2 (物质的量)时,进行反应:
CO(g)+2H2(g) CH3OH(g) ΔH= - 90.0 kJ·mol-1
CH3OH(g) ΔH= - 90.0 kJ·mol-1
下列措施不利于提高CO平衡转化率的措施是 。(填正确答案标号)
(1)已知:①CH3OH(l)+
 O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1; ②2CO(g)+O2(g)=2CO2(g) ΔH=- 566.0 kJ·mol-1
则反应③CH3OH(1)+O2(g)
 CO(g)+2H2O(g)的ΔH=
CO(g)+2H2O(g)的ΔH=(2)图中能正确表示反应③的平衡常数的对数(lgK)随着温度(T)变化的曲线是

(3)不同催化剂对CO和H2生成CH3OH的效果比较如下表所示:
| 催化剂种类 | 操作条件 | 性能比较 |
| 锌铬催化剂 (ZnO-Cr2O3) | 590 K-670 K 25 MPa-35 MPa | 选择性低 活性低 |
| 铜基催化剂 (CuO-ZnO-Al2O3) | 483 K-573 K 5 MPa-10 MPa | 选择性高(99%) 活性好 |
| 钯系催化剂 | ________ | 选择性低 活性一般 |
| 钼系催化剂 (MoS2-K2CO3-MgO-SiO2) | 533 K 8.1 MPa | 选择性53.2% CO的转化率36.1% |
②选择催化剂无须考虑的因素是
A.更长的使用寿命
B.在延长使用期间有更高的平衡转化率
C.较高的活性和优越的选择性,副产物少
D.在较大的合成气组成范围内的操作弹性
E.对硫敏感(易与杂质气体中的硫元素结合)
(4)某实验室控制CO和H2的初始投料比为1:2 (物质的量)时,进行反应:
CO(g)+2H2(g)
 CH3OH(g) ΔH= - 90.0 kJ·mol-1
CH3OH(g) ΔH= - 90.0 kJ·mol-1下列措施不利于提高CO平衡转化率的措施是 。(填正确答案标号)
| A.适当降低反应温度 |
| B.恒压条件下再充入a mol CO和2a mol H2 |
| C.恒容条件下再充入a mol CO和2a mol H2 |
| D.液化分离甲醇 |
您最近一年使用:0次
8 . 碘在科研与生活中有重要应用。某兴趣小组用 溶液、0.2%淀粉溶液、
溶液、0.2%淀粉溶液、 溶液、
溶液、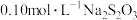 溶液等试剂,探究反应条件对化学反应速率的影响。
溶液等试剂,探究反应条件对化学反应速率的影响。
已知: (慢)
(慢)
 (快)
(快)
(1)向KI、 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的__________ (填离子符号)耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色, 与
与 初始的物质的量需满足的关系为
初始的物质的量需满足的关系为
__________ 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
表中
_____ ,理由是___________ 。
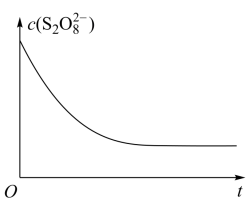
(3)已知某条件下, 和反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时
和反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时 与反应时间t的变化曲线(进行相应的标注)
与反应时间t的变化曲线(进行相应的标注)_____ 。
 溶液、0.2%淀粉溶液、
溶液、0.2%淀粉溶液、 溶液、
溶液、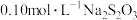 溶液等试剂,探究反应条件对化学反应速率的影响。
溶液等试剂,探究反应条件对化学反应速率的影响。已知:
 (慢)
(慢) (快)
(快)(1)向KI、
 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的 与
与 初始的物质的量需满足的关系为
初始的物质的量需满足的关系为
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
实验序号 | 体积V/mL | ||||
| 水 | KI溶液 |
| 淀粉溶液 | |
① | 10.0 | 0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 |
| 4.0 | 4.0 | 2.0 |
表中

(3)已知某条件下,
 和反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时
和反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时 与反应时间t的变化曲线(进行相应的标注)
与反应时间t的变化曲线(进行相应的标注)
您最近一年使用:0次
2020-10-04更新
|
293次组卷
|
4卷引用:四川省北大成都附属实验学校2020-2021学年高二下学期入学考试化学试题
四川省北大成都附属实验学校2020-2021学年高二下学期入学考试化学试题河北省唐山市玉田县2019-2020学年高二上学期期中考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 方法帮(已下线)第二章 化学反应速率与化学平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)