解题方法
1 . 氨气是重要的基础化工品。
Ⅰ.工业上使用氨气生产尿素,在一个体积恒为1L的恒温密闭容器中充入2mol 和4mol
和4mol 的混合气体,经历反应1、2合成
的混合气体,经历反应1、2合成 ,经历如下两个过程:
,经历如下两个过程:
反应1;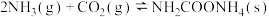

反应2: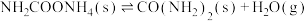

(1)能说明反应1达到平衡状态的是(暂不考虑反应2)_______ (填序号)。
①混合气体的压强不变
②混合气体的密度不变
③相同时间内断裂3mol N-H键,同时形成1mol
④混合气体的平均相对分子质量不变
⑤ 的体积分数不变
的体积分数不变
(2)混合气体中氨气体积分数及气体总浓度随时间变化如图所示,对于反应Ⅰ,A点正反应速率与B点逆反应速率大小关系是
_______  (填“>”“<”或“=”),在B点氨气的转化率为
(填“>”“<”或“=”),在B点氨气的转化率为_______ 。

Ⅱ.恒温恒容的密闭容器中,在某催化剂表面上发生
 。测得在同种催化剂下分解的实验数据如下表所示:
。测得在同种催化剂下分解的实验数据如下表所示:
(3)根据组①数据,随着反应进行,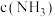 减小,平均反应速率
减小,平均反应速率_______ (填“变大”“变小”或“不变”),对该变化的合理解释是_______ 。
(4)在科学家推出合成氨反应在接近平衡时净反应速率方程式为: ,
, ,
, 分别为正、逆反应速率常数,p代表各组分的分压,如
分别为正、逆反应速率常数,p代表各组分的分压,如 ,其中
,其中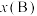 为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时
为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时 ,一定条件下,向容器中充入5mol
,一定条件下,向容器中充入5mol 和15mol
和15mol 的混合气体,平衡时氨气的质量分数为40%,试计算
的混合气体,平衡时氨气的质量分数为40%,试计算
_______ 。
Ⅰ.工业上使用氨气生产尿素,在一个体积恒为1L的恒温密闭容器中充入2mol
 和4mol
和4mol 的混合气体,经历反应1、2合成
的混合气体,经历反应1、2合成 ,经历如下两个过程:
,经历如下两个过程:反应1;
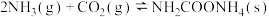

反应2:
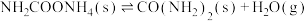

(1)能说明反应1达到平衡状态的是(暂不考虑反应2)
①混合气体的压强不变
②混合气体的密度不变
③相同时间内断裂3mol N-H键,同时形成1mol

④混合气体的平均相对分子质量不变
⑤
 的体积分数不变
的体积分数不变(2)混合气体中氨气体积分数及气体总浓度随时间变化如图所示,对于反应Ⅰ,A点正反应速率与B点逆反应速率大小关系是
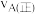
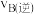 (填“>”“<”或“=”),在B点氨气的转化率为
(填“>”“<”或“=”),在B点氨气的转化率为
Ⅱ.恒温恒容的密闭容器中,在某催化剂表面上发生

 。测得在同种催化剂下分解的实验数据如下表所示:
。测得在同种催化剂下分解的实验数据如下表所示:| 编号 | 反应时间\min 表面积/cm2 | 0 | 20 | 40 | 60 | 80 |
| ① | a | 3.0 | 2.6 | 2.2 | 1.8 | 1.4 |
| ② | 2a | 3.0 | 2.2 | 1.4 | 1.0 | 1.0 |
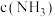 减小,平均反应速率
减小,平均反应速率(4)在科学家推出合成氨反应在接近平衡时净反应速率方程式为:
 ,
, ,
, 分别为正、逆反应速率常数,p代表各组分的分压,如
分别为正、逆反应速率常数,p代表各组分的分压,如 ,其中
,其中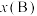 为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时
为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时 ,一定条件下,向容器中充入5mol
,一定条件下,向容器中充入5mol 和15mol
和15mol 的混合气体,平衡时氨气的质量分数为40%,试计算
的混合气体,平衡时氨气的质量分数为40%,试计算
您最近一年使用:0次
名校
2 . 氨气广泛应用于化肥、制药、合成纤维等领域。
Ⅰ.工业上可由氢气和氮气合成氨气。若用 、
、 、
、 、
、 分别表示N2、H2、NH3和催化剂,则在催化剂表面合成氨的过程如下图所示:
分别表示N2、H2、NH3和催化剂,则在催化剂表面合成氨的过程如下图所示:

(1)吸附后,能量状态最高的是_______ (填序号)。
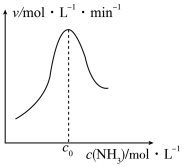
(2)结合上述过程,一定温度下在固体催化剂表面进行NH3的分解实验,发现NH3的分解速率与浓度的关系如下图所示。从吸附和解吸过程分析 ,c0前反应速率增加的原因可能是_______ ;c0之后反应速率降低的原因可能是_______ 。
Ⅱ.利用NH3在催化剂(V2O5-WO3/TiO2)作用下将NOx还原为N2是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是:
主反应:4NH3(g) +4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1
副反应:4NH3(g)+ 3O2(g) 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2
(3)根据盖斯定律可得:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3。则ΔH3=
5N2(g)+6H2O(g) ΔH3。则ΔH3=_______ (用含ΔH1、ΔH2的式子表示)。
(4)向脱硝反应的体系中添加NH4NO3可显著提高NO脱除率,原因可用一组离子方程式表示,请补充其中的1个离子方程式。(已知含氮微粒最终转化为N2)
① NO + NO = NO2 + NO
+ NO = NO2 + NO
② NO2 + 2NH = NO2(NH
= NO2(NH )2;
)2;_______
③ NO2(NH )2 + NO = 2N2 +3H2O + 2H+
)2 + NO = 2N2 +3H2O + 2H+
④ NH3 + H+ = NH
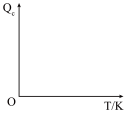
(5)化学反应的浓度商(用符号Qc表示)是可逆反应进行到一定程度,产物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比;达平衡时,浓度商就等于平衡常数K。若反应容器的体积固定不变,在坐标系中画出从常温时通入4 mol NH3和6 mol NO开始(仅发生反应:4NH3(g)+6NO(g) 5N2(g) + 6H2O(g) ΔH3<0),随温度(T/K)不断升高,浓度商Qc的变化趋势图
5N2(g) + 6H2O(g) ΔH3<0),随温度(T/K)不断升高,浓度商Qc的变化趋势图_______ 。
(6)氮氧化物脱除还可以利用电化学原理处理,利用如下图装置可同时吸收SO2和NO。已知:H2S2O4是一种弱酸。

阴极的电极反应式为_______ ,若没有能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
Ⅰ.工业上可由氢气和氮气合成氨气。若用
 、
、 、
、 、
、 分别表示N2、H2、NH3和催化剂,则在催化剂表面合成氨的过程如下图所示:
分别表示N2、H2、NH3和催化剂,则在催化剂表面合成氨的过程如下图所示:
(1)吸附后,能量状态最高的是
(2)结合上述过程,一定温度下在固体催化剂表面进行NH3的分解实验,发现NH3的分解速率与浓度的关系如下图所示。从

Ⅱ.利用NH3在催化剂(V2O5-WO3/TiO2)作用下将NOx还原为N2是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是:
主反应:4NH3(g) +4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1副反应:4NH3(g)+ 3O2(g)
 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2(3)根据盖斯定律可得:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3。则ΔH3=
5N2(g)+6H2O(g) ΔH3。则ΔH3=(4)向脱硝反应的体系中添加NH4NO3可显著提高NO脱除率,原因可用一组离子方程式表示,请补充其中的1个离子方程式。(已知含氮微粒最终转化为N2)
① NO
 + NO = NO2 + NO
+ NO = NO2 + NO
② NO2 + 2NH
 = NO2(NH
= NO2(NH )2;
)2;③ NO2(NH
 )2 + NO = 2N2 +3H2O + 2H+
)2 + NO = 2N2 +3H2O + 2H+④ NH3 + H+ = NH

(5)化学反应的浓度商(用符号Qc表示)是可逆反应进行到一定程度,产物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比;达平衡时,浓度商就等于平衡常数K。若反应容器的体积固定不变,在坐标系中画出从常温时通入4 mol NH3和6 mol NO开始(仅发生反应:4NH3(g)+6NO(g)
 5N2(g) + 6H2O(g) ΔH3<0),随温度(T/K)不断升高,浓度商Qc的变化趋势图
5N2(g) + 6H2O(g) ΔH3<0),随温度(T/K)不断升高,浓度商Qc的变化趋势图
(6)氮氧化物脱除还可以利用电化学原理处理,利用如下图装置可同时吸收SO2和NO。已知:H2S2O4是一种弱酸。

阴极的电极反应式为
您最近一年使用:0次
3 . “温室效应”是全球关注的环境问题之一。 是目前大气中含量最高的一种温室气体。因此,控制
是目前大气中含量最高的一种温室气体。因此,控制 的排放和
的排放和 的资源化利用是解决温室效应的有效途径。
的资源化利用是解决温室效应的有效途径。
(1)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

①反应Ⅰ自发进行的条件_______ 。(填“高温”或“低温”)
②一定条件下,向体积为2L的恒容密闭容器中通入0.1mol 和0.3mol
和0.3mol 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为0.02mol,
为0.02mol, 为0.04mol,此时
为0.04mol,此时 的转化率
的转化率_______ 。反应Ⅰ的转化常数为_______ 。
③在某温度下,向VL的密闭容器中充入不同 的原料气,若只发生反应Ⅰ,请在如图中画出平衡时氢气转化率的变化趋势图
的原料气,若只发生反应Ⅰ,请在如图中画出平衡时氢气转化率的变化趋势图_______ 。

(2)文献报道某课题组利用 与
与 在铁、镍催化作用下制甲烷的研究过程如下:
在铁、镍催化作用下制甲烷的研究过程如下:

反应结束后,气体中检测到 和
和 ,滤液中检测到
,滤液中检测到 ,固体中检测到镍粉和
,固体中检测到镍粉和 ,
, 、
、 、
、 的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):

研究人员根据实验结果得出结论: 是
是 转化为
转化为 的中间体,即:
的中间体,即:
①由图可知,镍粉是_______ 。(填字母)
A.反应Ⅰ、Ⅱ的催化剂 B.反应Ⅱ的催化剂
C.反应Ⅰ的催化剂 D.不是催化剂
②当镍粉用量从1mmol增加到10mmol,反应速率Ⅰ、Ⅱ的变化情况是_______ 。
(3) 循环在氢能的贮存/释放、燃料电池等方面具有重要应用。例如:
循环在氢能的贮存/释放、燃料电池等方面具有重要应用。例如: 催化储氢,在密闭容器中,向含有催化剂的
催化储氢,在密闭容器中,向含有催化剂的 溶液(
溶液( 与KOH溶液反应制得)中通入
与KOH溶液反应制得)中通入 生成
生成 ,其离子方程式为
,其离子方程式为 。
。
①有关说法正确的是_______ 。
A.这种储氢方式便于运输
B.释氢过程中,每消耗3.6g 放出4.48L的
放出4.48L的
C.储氢过程中 被氧化
被氧化
D.这种储氢方法与金属或合金的储氢都属于化学方法
②其他条件不变, 转化为
转化为 的转化率随温度的变化如图所示。反应温度在80℃~120℃范围内,
的转化率随温度的变化如图所示。反应温度在80℃~120℃范围内, 催化加氢的转化率下降的可能原因是
催化加氢的转化率下降的可能原因是_______ 。

 是目前大气中含量最高的一种温室气体。因此,控制
是目前大气中含量最高的一种温室气体。因此,控制 的排放和
的排放和 的资源化利用是解决温室效应的有效途径。
的资源化利用是解决温室效应的有效途径。(1)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


Ⅲ.


①反应Ⅰ自发进行的条件
②一定条件下,向体积为2L的恒容密闭容器中通入0.1mol
 和0.3mol
和0.3mol 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为0.02mol,
为0.02mol, 为0.04mol,此时
为0.04mol,此时 的转化率
的转化率③在某温度下,向VL的密闭容器中充入不同
 的原料气,若只发生反应Ⅰ,请在如图中画出平衡时氢气转化率的变化趋势图
的原料气,若只发生反应Ⅰ,请在如图中画出平衡时氢气转化率的变化趋势图
(2)文献报道某课题组利用
 与
与 在铁、镍催化作用下制甲烷的研究过程如下:
在铁、镍催化作用下制甲烷的研究过程如下:
反应结束后,气体中检测到
 和
和 ,滤液中检测到
,滤液中检测到 ,固体中检测到镍粉和
,固体中检测到镍粉和 ,
, 、
、 、
、 的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:
 是
是 转化为
转化为 的中间体,即:
的中间体,即:
①由图可知,镍粉是
A.反应Ⅰ、Ⅱ的催化剂 B.反应Ⅱ的催化剂
C.反应Ⅰ的催化剂 D.不是催化剂
②当镍粉用量从1mmol增加到10mmol,反应速率Ⅰ、Ⅱ的变化情况是
(3)
 循环在氢能的贮存/释放、燃料电池等方面具有重要应用。例如:
循环在氢能的贮存/释放、燃料电池等方面具有重要应用。例如: 催化储氢,在密闭容器中,向含有催化剂的
催化储氢,在密闭容器中,向含有催化剂的 溶液(
溶液( 与KOH溶液反应制得)中通入
与KOH溶液反应制得)中通入 生成
生成 ,其离子方程式为
,其离子方程式为 。
。①有关说法正确的是
A.这种储氢方式便于运输
B.释氢过程中,每消耗3.6g
 放出4.48L的
放出4.48L的
C.储氢过程中
 被氧化
被氧化D.这种储氢方法与金属或合金的储氢都属于化学方法
②其他条件不变,
 转化为
转化为 的转化率随温度的变化如图所示。反应温度在80℃~120℃范围内,
的转化率随温度的变化如图所示。反应温度在80℃~120℃范围内, 催化加氢的转化率下降的可能原因是
催化加氢的转化率下降的可能原因是
您最近一年使用:0次



