解答题-实验探究题
|
较易(0.85)
|
1 . 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素。设计的实验及部分现象如下:
【实验1】将一小块钠和镁片分别放入滴有酚酞溶液的冷水中
【实验2】将表面积大致相同的镁片和铝片(均已预处理),分别投入足量相同体积的0.5 mol/L盐酸中
【实验3】将相同质量的镁片(已预处理)和铝粉分别投入到足量相同体积的0.5 mol/L盐酸和3 mol/L盐酸中
(1)实验1中钠和水反应的化学方程式是_______________________________________ 。
(2)下列操作能达到实验2中“预处理”效果的是________________ (填序号)。
a.用砂纸打磨镁片和铝片
b.用盐酸浸泡镁片和铝片片刻
c.用烧碱溶液浸泡镁片和铝片片刻
(3)由实验2可得出决定化学反应速率的主要因素是___________________________ 。
(4)实验3中铝粉消失所用的时间短。由此该同学得出结论:铝比镁的金属性强。你认为该结论是否正确并说明原因____________________________________________ 。
【实验1】将一小块钠和镁片分别放入滴有酚酞溶液的冷水中
【实验2】将表面积大致相同的镁片和铝片(均已预处理),分别投入足量相同体积的0.5 mol/L盐酸中
【实验3】将相同质量的镁片(已预处理)和铝粉分别投入到足量相同体积的0.5 mol/L盐酸和3 mol/L盐酸中
(1)实验1中钠和水反应的化学方程式是
(2)下列操作能达到实验2中“预处理”效果的是
a.用砂纸打磨镁片和铝片
b.用盐酸浸泡镁片和铝片片刻
c.用烧碱溶液浸泡镁片和铝片片刻
(3)由实验2可得出决定化学反应速率的主要因素是
(4)实验3中铝粉消失所用的时间短。由此该同学得出结论:铝比镁的金属性强。你认为该结论是否正确并说明原因
您最近一年使用:0次
2017-07-13更新
|
342次组卷
|
2卷引用:北京市西城区2016-2017学年高一下学期期末考试化学试题
2 . 下列实验中,可以加快反应速率的是
| A.锌与稀硫酸反应时,加入少量CuSO4固体 |
| B.钠与水反应时,增加水的量 |
| C.用18mol/L的硫酸溶液代替2mol/L硫酸溶液常温下与铝反应 |
| D.锌与稀硫酸反应时,加入少量醋酸钠固体 |
您最近一年使用:0次
名校
3 . 一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:
C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:

 C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:
C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:
| A.增加A的物质的量,正反应速率加快 |
| B.平衡时,其他条件不变,当温度升高时,转化率变大 |
| C.图中曲线的斜率表示反应的化学平衡常数 |
| D.平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
您最近一年使用:0次
4 . 下列措施对增大反应速率明显有效的是
| A.用锌与稀硫酸反应制备氢气时,加入少量硫酸铜 |
| B.Al与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸 |
| C.Fe与稀硫酸反应时,把铁粉改为铁片 |
| D.Na与水反应时增大水的用量 |
您最近一年使用:0次
名校
5 . 少量铁粉与l00mL 0.0lmol/L的硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①再加l00mL 0.0lmol/L的H2SO4 ②升高温度 ③加入少量锌粉
④加CH3COONa固体 ⑤改用l0mL 0.Imol/L硫酸 ⑥加入硫酸钠固体
⑦加几滴1mol/L的盐酸
①再加l00mL 0.0lmol/L的H2SO4 ②升高温度 ③加入少量锌粉
④加CH3COONa固体 ⑤改用l0mL 0.Imol/L硫酸 ⑥加入硫酸钠固体
⑦加几滴1mol/L的盐酸
| A.①②⑥ | B.②③⑤ | C.②④⑦ | D.②⑤⑦ |
您最近一年使用:0次
名校
6 . 少量铁片与过量的l00mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②改用50mL 1mol/L HNO3溶液 ③滴入几滴浓盐酸 ④加入少量铜粉
⑤滴入几滴硫酸铜溶液 ⑥升高温度(不考虑盐酸挥发)⑦改用50mL 0.1mol/L盐酸.
①加H2O ②改用50mL 1mol/L HNO3溶液 ③滴入几滴浓盐酸 ④加入少量铜粉
⑤滴入几滴硫酸铜溶液 ⑥升高温度(不考虑盐酸挥发)⑦改用50mL 0.1mol/L盐酸.
| A.②⑥⑦ | B.③④⑤ | C.③④⑥⑦ | D.③⑤⑥ |
您最近一年使用:0次
2017-06-13更新
|
269次组卷
|
2卷引用:福建省漳平市第一中学2016-2017学年高一下学期第二次月考化学试题
名校
7 . 100mL 6mol.L-1的硫酸溶液与过量锌粉反应,在一定温度下为了减缓反应速率但又不影响生成氢气的总质量,可向反应物中加入适量的
| A.硝酸 | B.水 | C.硫酸氢钾 | D.氯化氢气体 |
您最近一年使用:0次
名校
8 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________ 。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______ (答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______ 。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______ 。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________ 。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______ ,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________ (写一种方法即可).

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ |
| 开始沉淀时的pH | 2.7 | — | — |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式
您最近一年使用:0次
2017-06-01更新
|
522次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2017届高三5月押题考试理综化学试题
名校
解题方法
9 . I.控制变量法是化学实验中的—种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点—位),分析以下数据,回答下列问题:
(1)实验①和实验②表明_____ 对反应速率有影响;研究锌的形状对反应速率的影响时,最好选取实验_______ (填3个实验序号)。
(2)下列数据推断正确的是______________________ 。
A. t1<70 B.t1>t4C.m12D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是___________________________________ 。
(4)根据表中数据计算:硫酸的物质的量浓度是_________________ mol/L。
II.已知在 25℃、l0l kPa 下,2NO(g)+2CO(g) N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
(1) 0〜15min 内,v(CO2) =__________________ 。
(2)该反应的速率时间图象如下图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如下图中右图所示。以下说法正确的是______ (填对应字母)。
A.a1>a2B.b12C.t1>t2
(3) 一定条件下,已知反应NO2(g)+SO2(g) NO(g)+SO3(g),将NO2与SO2以体积比1 :2置于2L密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是
NO(g)+SO3(g),将NO2与SO2以体积比1 :2置于2L密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是_____
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2与SO2的体积比保持不变 d.每消耗lmol SO2的同时生成lmol NO
序号 | 硫酸的体积 /mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的 时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | 19.3 |
(1)实验①和实验②表明
(2)下列数据推断正确的是
A. t1<70 B.t1>t4C.m12D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是
(4)根据表中数据计算:硫酸的物质的量浓度是
II.已知在 25℃、l0l kPa 下,2NO(g)+2CO(g)
 N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。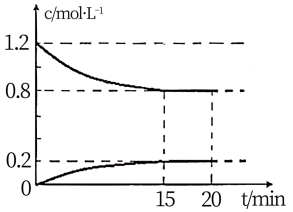
(1) 0〜15min 内,v(CO2) =
(2)该反应的速率时间图象如下图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如下图中右图所示。以下说法正确的是
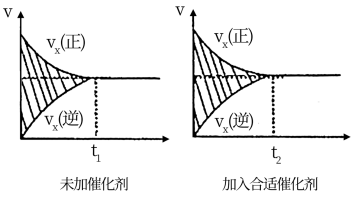
A.a1>a2B.b12C.t1>t2
(3) 一定条件下,已知反应NO2(g)+SO2(g)
 NO(g)+SO3(g),将NO2与SO2以体积比1 :2置于2L密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是
NO(g)+SO3(g),将NO2与SO2以体积比1 :2置于2L密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2与SO2的体积比保持不变 d.每消耗lmol SO2的同时生成lmol NO
您最近一年使用:0次
名校
10 . 下列有关化学反应速率的说法不正确的是
| A.糕点包装内放置小包除氧剂,可降低包装袋中氧气浓度,延长糕点保质期 |
| B.一些橡胶或塑料制品中加入抑制剂,目的是降低反应速率,延长材料的使用寿命 |
| C.为了提高煤燃烧的效率,可通入适当过量的空气 |
| D.锌粒与稀硫酸反应,其他条件不变,加入锌粉,对化学反应速率没有影响 |
您最近一年使用:0次



