名校
1 . 某同学在试管中做铁钉与稀硫酸反应的实验,发现反应速率较慢,下列措施:①给试管加热 ②加入铁粉 ③加入冰块④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,能加快反应速率的是
| A.①②⑤ | B.①② | C.③④ | D.③④⑤ |
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
4卷引用:2015-2016学年甘肃省兰州一中高一下期末化学试卷
11-12高二上·黑龙江·期中
2 . 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A.NaOH固体 | B.NH4Cl固体 |
| C.CH3COONa固体 | D.NaNO3固体 |
您最近一年使用:0次
2016-12-09更新
|
174次组卷
|
3卷引用:2011-2012年黑龙江哈三中高二上学期期中考试化学(理)试卷
(已下线)2011-2012年黑龙江哈三中高二上学期期中考试化学(理)试卷2015-2016学年湖北省武汉三十九中高二上学期期末化学试卷湖南省邵阳市第十一中学2020-2021学年高二上学期期中考试化学试题
解题方法
3 . 实验室用100mL1mol/L盐酸与锌粉反应,下列措施能使反应速率加快的是
| A.降低温度 |
| B.改用300mL1mol/L盐酸 |
| C.改用100mL3mol/L盐酸 |
| D.用等量锌粒代替锌粉 |
您最近一年使用:0次
12-13高一下·河北石家庄·期末
4 . 为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)不变,生成H2量不变 |
| B.加入少量水,v(H2)减小,生成H2量减少 |
| C.加入CH3COONa固体,v(H2)减小,生成H2量不变 |
| D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少 |
您最近一年使用:0次
2016-12-09更新
|
160次组卷
|
5卷引用:2012-2013学年河北省石家庄市高一下学期期末考试化学试卷
(已下线)2012-2013学年河北省石家庄市高一下学期期末考试化学试卷2015-2016学年河北正定中学高二上学期第一次联考化学试卷2015-2016学年浙江省桐乡市高级中学高二上期中(普通班)化学试卷云南省玉溪市民族中学2017-2018学年高二上学期期中考试化学试卷河南省开封市五县联考2020-2021学年高一下学期期末考试化学试题
5 . 下列实验方法或装置正确的是


| A.用图1所示装置制取乙烯 |
| B.用图2所示方法验证HCl气体易溶于水 |
| C.用图3所示方法探究固体表面积对反应速率的影响 |
| D.用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯 |
您最近一年使用:0次
2016-12-09更新
|
204次组卷
|
5卷引用:2015届江苏省南京市高三第三次模拟考试化学试卷
名校
6 . 足量Zn粉与50mL、 0.1 mol∙L−1的稀硫酸充分反应。为了减慢此反应速率而不改变H2的产量,可以使用如下方法中的
①加Na2SO4溶液;②改用50mL、0.1 mol∙L−1的稀盐酸;③改用50mL、0.05 mol∙L−1的硝酸;④加适量Na2CO3溶液;⑤减压;⑥冰水浴;
①加Na2SO4溶液;②改用50mL、0.1 mol∙L−1的稀盐酸;③改用50mL、0.05 mol∙L−1的硝酸;④加适量Na2CO3溶液;⑤减压;⑥冰水浴;
| A.①⑥ | B.①⑤⑥ | C.①②⑤⑥ | D.①②③⑤⑥ |
您最近一年使用:0次
2016-12-09更新
|
239次组卷
|
2卷引用:2014-2015江西省赣州市十二县高一第二学期期中联考化学试卷
解题方法
7 . 下列措施是为了减慢化学反应速率的是
| A.合成氨工业中使用催化剂 |
| B.用铁粉代替铁钉与稀硫酸反应制取氢气 |
| C.食品放在冰箱中贮藏 |
| D.在试管中进行铝和盐酸反应时,稍微加热 |
您最近一年使用:0次
2016-12-09更新
|
124次组卷
|
2卷引用:2014秋江苏省南通中学高二上学期期中化学(必修)试卷
13-14高一·全国·课时练习
8 . 煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达到一定的浓度遇明火即迅速爆炸,其原因是( )。
| A.粉末状态的煤比块状煤的着火点低 |
| B.粉末状态的煤比块状煤放出的热量多 |
| C.粉末状态的煤比块状煤的总表面积大 |
| D.粉末状态的煤呈气态,属于可燃性气体 |
您最近一年使用:0次
2016-12-09更新
|
580次组卷
|
3卷引用:2014学年高一化学人教版必修2 2.3.2反应限度条件的控制练习卷
13-14高三·全国·课时练习
9 . 硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI⇌H2↑+I2
Ⅲ.2H2SO4=2SO2+O2↑+2H2O
(1)分析上述反应,下列判断正确的是_______ 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时间的变化如图所示。

①0~2 min内的平均反应速率v(HI)=_______ 。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_______ 是原来的2倍。
a.HI的平衡浓度 b.达到平衡的时间 c.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列固体试剂中的_______ ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI⇌H2↑+I2
Ⅲ.2H2SO4=2SO2+O2↑+2H2O
(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时间的变化如图所示。

①0~2 min内的平均反应速率v(HI)=
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
a.HI的平衡浓度 b.达到平衡的时间 c.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列固体试剂中的
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
您最近一年使用:0次
2014高三·全国·专题练习
解题方法
10 . 偶氮苯是橙红色晶体,溶于乙醇,微溶于水,广泛应用于染料制造和橡胶工业,以硝基苯、镁粉和甲醇为原料制备偶氮苯的实验步骤如下:
步骤1:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。
步骤2:等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤3:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤4:用95%的乙醇重结晶。
(1)步骤1中反应不需要加热就能剧烈进行,原因是_______ 。镁粉分两次加入而不是一次性全部加入的原因是_______ 。
(2)步骤3中析出固体用冰水洗涤的原因是_______ 。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管(应接管)和锥形瓶外还应有_______ 。
(3)取0.1 g偶氮苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1 cm处,再将滤纸条末端浸入装有1∶3的苯环己烷溶液的容器中,实验操作及现象如下图所示:
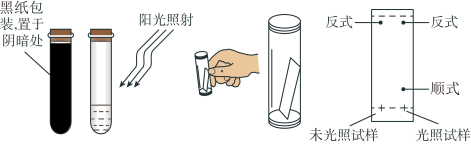
①实验中分离物质所采用的方法是_______ 法。
②由实验结果可知:_______ ;利用该方法可以提纯反式偶氮苯。
步骤1:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。
步骤2:等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤3:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤4:用95%的乙醇重结晶。
(1)步骤1中反应不需要加热就能剧烈进行,原因是
(2)步骤3中析出固体用冰水洗涤的原因是
(3)取0.1 g偶氮苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1 cm处,再将滤纸条末端浸入装有1∶3的苯环己烷溶液的容器中,实验操作及现象如下图所示:

①实验中分离物质所采用的方法是
②由实验结果可知:
您最近一年使用:0次



