名校
1 . 100 mL 6 mol·L-1的H2SO4跟过量锌粉反应,在一定温度下,要想加快反应进行的速率,但又不影响生成的氢气的总量,可向反应物中加入适量的
| A.适量浓H2SO4 | B.铜 | C.醋酸钠固体 | D.硝酸钾溶液 |
您最近一年使用:0次
名校
2 . 用锌片与1mol·L-l 稀盐酸反应制取氢气,下列措施不能使反应速率增大的是
| A.改用锌粉. | B.滴入几滴硫酸铜溶液 |
| C.加入少量1mol·L-1稀硫酸 | D.加入少量NaCl溶液 |
您最近一年使用:0次
2017-05-03更新
|
292次组卷
|
5卷引用:江苏省宿迁市名校2016-2017学年高一下学期期中考试化学试题
名校
3 . 下列与化学反应速率的影响因素无关 的是
| A.建筑中使用的铝合金门窗比钢门窗更耐腐蚀 |
| B.窗帘上直接受阳光照射的一面布料容易褪色 |
| C.肉放在冷冻箱中要比放在保鲜箱中存放的时间更长久 |
| D.实验室用硫酸溶液与锌粒反应制取氢气,反应一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又重新增多起来 |
您最近一年使用:0次
2017-05-02更新
|
177次组卷
|
2卷引用:安徽省宣城市三校(郎溪中学、宣城二中、广德中学)2016-2017学年高一下学期期中联考化学试题
名校
4 . 下列做法,不能使Zn+2HCl = ZnCl2 + H2↑的反应速率增大的是
| A.增大盐酸的浓度 | B.降低温度 |
| C.用锌粉代替锌粒 | D.滴加少量CuCl2溶液 |
您最近一年使用:0次
名校
解题方法
5 . 石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为供源制备碳酸镁晶须(MgCO3·nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__________ 。
(2)为提高水浸速率,可采取的措施为_________ (任写一条)。“浸渣”的主要成分为________ 。
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是_________ (填字母代号)。
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为________________ 。
(5)流程中可以循环利用的物质是________ (填化学式)。

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4
 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑(1)写出焙烧产物NH3的电子式
(2)为提高水浸速率,可采取的措施为
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为
(5)流程中可以循环利用的物质是
您最近一年使用:0次
名校
6 . 用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是
| A.给反应体系适当加热 | B.向反应体系中加水稀释 | C.加入少量氧化铜固体 | D.加压 |
您最近一年使用:0次
解题方法
7 . 辉铜矿是铜矿的主要品种之一传统的火法冶炼在资源的综合利用、环境保护等方面会遇到困难。辉铜矿的湿法冶炼目前国内外都处于探索阶段。自氧化还氨氮分离法是一种较为理想的湿法冶炼方法,工艺流程如下图所示:
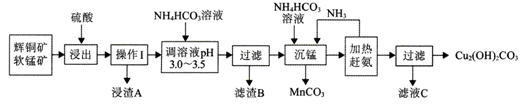
已知:
① 辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等。
② 软锰矿的主要成分是MnO2,含有较多的SiO2等。
③ 浸出时,生成一种非金属单质。
④ 室温下,Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Fe(OH)2]=8.0×10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是__________ 。
(2)写山浸出时主要反应的离子方程式_____________ 。
(3)浸渣A的主要成分为_______ ;调溶液pH 3.0-3.5的目的是除去______ 离子;室温下,若该离子的浓度为4.0×10-8mol/L,则溶液的pH=__________ 。
(4) 工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为_________________ 。
(5)从滤液C中提取硫酸氨晶体的步骤为_______ 、_______ 、过滤、洗涤、干燥。
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有________ 、_____ 。(列举其中2条)

已知:
① 辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等。
② 软锰矿的主要成分是MnO2,含有较多的SiO2等。
③ 浸出时,生成一种非金属单质。
④ 室温下,Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Fe(OH)2]=8.0×10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是
(2)写山浸出时主要反应的离子方程式
(3)浸渣A的主要成分为
(4) 工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为
(5)从滤液C中提取硫酸氨晶体的步骤为
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有
您最近一年使用:0次
2017-04-11更新
|
216次组卷
|
2卷引用:2017届贵州省高三下学期普通高等学校招生适应性考试理综化学试卷
解题方法
8 . 我国目前大多数工厂以铬铁矿(主要成份为 FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。 步骤①中涉及的主要反应是:
4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2。
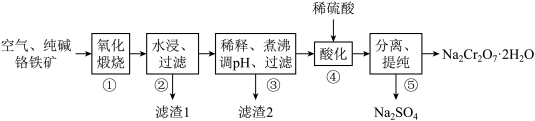
回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为______ , 氧化煅烧时将铬铁矿粉碎的目的是 ____________ 。
(2)①中杂质 Al2O3 与纯碱反应转变为可溶性盐,写出 Al2O3与纯碱反应的化学方程式________ ,滤渣1的主要成分为MgO和_______ ( 填化学式) 。
(3)滤渣2的成分是___________ ( 填化学式) 。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,发生反应的离子方程式为__________ 。
(5)该工艺的酸性废液中含有Cr2O72-,向废液中加入绿矾(FeSO4·7H2O)还原处理,反应的离子方程式是__________ ; 再向处理后的溶液中加入石灰水,使 c(Cr3+)降至10-5mol/L, 此时溶液的pH值为 ______ (已知:该条件下,Ksp[Cr(OH)3]=1.0×10-32)。
4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2。

回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为
(2)①中杂质 Al2O3 与纯碱反应转变为可溶性盐,写出 Al2O3与纯碱反应的化学方程式
(3)滤渣2的成分是
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,发生反应的离子方程式为
(5)该工艺的酸性废液中含有Cr2O72-,向废液中加入绿矾(FeSO4·7H2O)还原处理,反应的离子方程式是
您最近一年使用:0次
名校
解题方法
9 . 工业上用矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)获取铜和胆矾的操作流程如下:
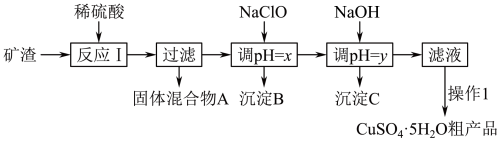
已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
②B、C均为单一沉淀
请回答下列问题:
(1)已知Cu2O在酸性条件下发生自身氧化还原反应,写出离子反应方程式______________ 。
(2)为了加快反应I的速率,可以采取的措施是______________ (写1点)。
(3)固体混合物A中的成分是__________________________ 。
(4)反应I完成后,铁元素的存在形式为_______________ (填离子符号);写出生成该离子的离子方程式___________________________________ 。
(5)x对应的数值范围是_______________________ 。用NaClO调pH,生成沉淀B的反应的离子方程式为____________________________________ 。
(6)已知:Ksp[Al(OH)3]=1.1×10-33,当调节溶液的pH为5时,c(Al3+)=_________ mol•L-1
(7)洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤.原因是___________________ 。

已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
请回答下列问题:
(1)已知Cu2O在酸性条件下发生自身氧化还原反应,写出离子反应方程式
(2)为了加快反应I的速率,可以采取的措施是
(3)固体混合物A中的成分是
(4)反应I完成后,铁元素的存在形式为
(5)x对应的数值范围是
(6)已知:Ksp[Al(OH)3]=1.1×10-33,当调节溶液的pH为5时,c(Al3+)=
(7)洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤.原因是
您最近一年使用:0次
10 . 一位科学家利用Zn 与某浓度的盐酸反应研究影响化学反应速率的因素,他得到的实验数据如下:

利用上述数据,完成下列问题:
(1)画出时间对温度的曲线图。___________
(2)利用所画的曲线图和上述实验数据,得出关于温度影响反应速率的什么结论?___________
(3)对比数据B与F,解释F溶于酸那么快的原因。___________

利用上述数据,完成下列问题:
(1)画出时间对温度的曲线图。
(2)利用所画的曲线图和上述实验数据,得出关于温度影响反应速率的什么结论?
(3)对比数据B与F,解释F溶于酸那么快的原因。
您最近一年使用:0次



