名校
1 . 哈伯工业合成氨的流程如图,为提高原料平衡转化率采取的措施是
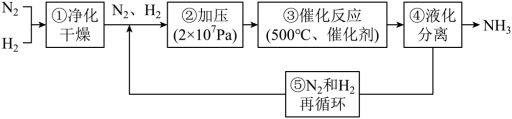

| A.①②③④⑤ | B.②③④⑤ | C.②④⑤ | D.②③④ |
您最近一年使用:0次
2022-10-21更新
|
179次组卷
|
18卷引用:安徽省宣城市2018-2019学年高二下学期期末考试化学试题
安徽省宣城市2018-2019学年高二下学期期末考试化学试题山西省长治市第二中学2019-2020学年高二上学期12月月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第四节 化学反应的调控 方法帮江西省九江市第一中学2021-2022学年高二上学期第一次月考化学试题山西省太原市2019-2020学年高二上学期期中测评化学试题山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省齐齐哈尔市第八中学2022-2023学年高二上学期10月月考化学试题重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题天津市部分区2022-2023 学年高三上学期1月期末考试化学试题广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题第二章 化学反应速率与化学平衡 第四节 化学反应的调控河南省濮阳市第一高级中学2023-2024学年高二上学期9月月考化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷湖北省武汉市重点中学5G联合体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 .  与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。
。
(1)已知上述反应中相关的化学键键能数据如下:
则该反应的
___________ 。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入 和
和 各
各 的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________ (填“A”或“B”)。
(2)有利于提高 平衡转化率的条件是___________。
平衡转化率的条件是___________。
(3)某温度下,在体积为2L的容器中加入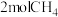 、
、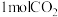 、以及催化剂进行重整反应,达到平衡时
、以及催化剂进行重整反应,达到平衡时 的转化率是
的转化率是 ,其平衡常数为
,其平衡常数为___________ 。
(4)按一定体积比加入 和
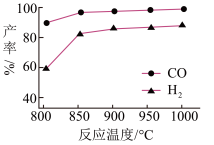
和 ,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为
,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为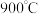 的原因是
的原因是___________ 。
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。
。(1)已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | 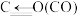 | |
| 键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |

 和
和 各
各 的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是(2)有利于提高
 平衡转化率的条件是___________。
平衡转化率的条件是___________。| A.高温低压 |
| B.低温高压 |
| C.高温高压 |
| D.低温低压 |
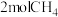 、
、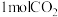 、以及催化剂进行重整反应,达到平衡时
、以及催化剂进行重整反应,达到平衡时 的转化率是
的转化率是 ,其平衡常数为
,其平衡常数为(4)按一定体积比加入
 和
和 ,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为
,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为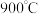 的原因是
的原因是
您最近一年使用:0次
名校
3 . 由丙烯合成正丁醛的反应: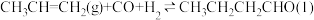 。该反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
。该反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
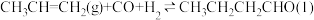 。该反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
。该反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是| A.低温、高压、催化剂 | B.适当的温度、高压、催化剂 |
| C.常温、常压、催化剂 | D.适当的温度、常压、催化剂 |
您最近一年使用:0次
2021-10-13更新
|
173次组卷
|
4卷引用:新疆伊犁市奎屯市第一高级中学2019-2020学年高二上学期期中考试化学试题
名校
4 . 丙烯是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。另外,丙烯可制备1,2-二氯丙烷,丙烯醛等。回答下列问题:
I.工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①CH2=CHCH3(g)+Cl2(g)⇌CH2ClCHClCH3(g) △H1=-134kJ∙mol-1
②CH2=CHCH3(g)+Cl2(g)⇌CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ∙mol-1
(1)已知CH2=CHCH2Cl(g)+HCl(g)⇌CH2ClCHClCH3(g)的活化能Ea(逆)为164kJ∙mol-1,则该反应的活化能Ea(正)为_______ kJ∙mol-1
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
用单位时间内气体分压的变化来表示反应速率,即ν=△p/△t,则反应①前180min内平均反应速率ν(CH2ClCHClCH3)=_____ Kpa/min-1(保留小数点后2位)。
II.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯反应:C3H8(g)⇌C3H6(g)+H2(g) △H=+124kJ∙mol-1
(3)①某温度下,在刚性容器中充入C3H8,起始压强为10kpa,平衡时总压强为14kpa,C3H8(的平衡转化率为____ 。该反应的平衡常数Kp=____ Kpa(保留小数点后2位)
②总压分别为100kpa和10kpa时发生该反应,平衡体系中C3H8和C3H6的物质的量分数随温度变化关系如图所示。

10kpa时C3H8和C3H6的物质的量分数随温度变化关系的曲线分别是____ 、____ 。
③高温下,丙烷生成丙烯的反应在初期阶段的速率方程为:r=k×c(C3H8),其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是____ 。
A.增加丙烷浓度,r增大 B.增加H2浓度,r增大
C.丙烯的生成速率逐渐增大 D.降低反应温度,k减小
方法二:丙烷氧化脱氢法制备丙烯还生成CO、CO2等副产物,制备丙烯的反应:C3H8(g)+1/2O2(g)⇌ C3H6(g)+H2O(g) △H=-118kJ∙mol-1,在催化剂的作用下C3H8的转化率和C3H6的产率随温度变化关系如图2所示。

(4)图中C3H8的转化率随温度升高而上升的原因是_____ ,观察图2,回答能提高C3H6选择性的措施是___ (C3H6的选择性= )
)
I.工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①CH2=CHCH3(g)+Cl2(g)⇌CH2ClCHClCH3(g) △H1=-134kJ∙mol-1
②CH2=CHCH3(g)+Cl2(g)⇌CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ∙mol-1
(1)已知CH2=CHCH2Cl(g)+HCl(g)⇌CH2ClCHClCH3(g)的活化能Ea(逆)为164kJ∙mol-1,则该反应的活化能Ea(正)为
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/KPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
用单位时间内气体分压的变化来表示反应速率,即ν=△p/△t,则反应①前180min内平均反应速率ν(CH2ClCHClCH3)=
II.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯反应:C3H8(g)⇌C3H6(g)+H2(g) △H=+124kJ∙mol-1
(3)①某温度下,在刚性容器中充入C3H8,起始压强为10kpa,平衡时总压强为14kpa,C3H8(的平衡转化率为
②总压分别为100kpa和10kpa时发生该反应,平衡体系中C3H8和C3H6的物质的量分数随温度变化关系如图所示。

10kpa时C3H8和C3H6的物质的量分数随温度变化关系的曲线分别是
③高温下,丙烷生成丙烯的反应在初期阶段的速率方程为:r=k×c(C3H8),其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是
A.增加丙烷浓度,r增大 B.增加H2浓度,r增大
C.丙烯的生成速率逐渐增大 D.降低反应温度,k减小
方法二:丙烷氧化脱氢法制备丙烯还生成CO、CO2等副产物,制备丙烯的反应:C3H8(g)+1/2O2(g)⇌ C3H6(g)+H2O(g) △H=-118kJ∙mol-1,在催化剂的作用下C3H8的转化率和C3H6的产率随温度变化关系如图2所示。

(4)图中C3H8的转化率随温度升高而上升的原因是
 )
)
您最近一年使用:0次
2021-06-15更新
|
959次组卷
|
4卷引用:江西省临川一中暨临川一中实验学校2021届高三第三次模拟理科综合能力测试化学试题
江西省临川一中暨临川一中实验学校2021届高三第三次模拟理科综合能力测试化学试题(已下线)2020年山东卷化学高考真题变式题16-20四川省成都石室中学2022—2023学年高二上学期期中考试化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷
名校
5 . 工业烟气、汽车尾气中的氮氧化物(NOx),可由多种方法进行脱除。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。
a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H___ 0(填“>”、“=”或“<”)。整个反应历程中的控速步骤为第___ 步(选填a、b、c或d),其能垒(活化能)为___ Kcal·mol-1。
(2)利用放热反应C(s)+2NO(g) CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)__ (选填a、b、c或d,下同),表示600℃条件下pCO2的是___ 。
②根据图示,列出600℃时反应平衡常数Kp的计算式__ 。(Kp等于生成物气体分压幂之积与反应物气体分压幂之积的比值)
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。____ (填标号)。
A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是____ (任写一条)。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。

a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H
(2)利用放热反应C(s)+2NO(g)
 CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)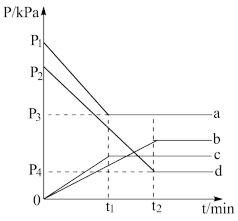
②根据图示,列出600℃时反应平衡常数Kp的计算式
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。

A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是
您最近一年使用:0次
2021-03-25更新
|
299次组卷
|
2卷引用:江苏省泰州中学2019-2020学年高二下学期第二次月考化学试题
名校
解题方法
6 . 无色碘化钾溶液露置在空气中容易变为黄色,某兴趣小组进行如下实验探究。
实验试剂:1mol·L-1 KI溶液、0.2mol·L-1 H2SO4溶液、蒸馏水
实验仪器:试管、试剂瓶、胶头滴管、温度计
I.针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验:
回答下列问题:
(1)该实验的目的是探究________ 对反应速率的影响。
(2)该实验除上述试剂和仪器外,还需要的仪器是_____ ,试剂是_____ 。
(3)分析上述实验记录结果,可得出的结论是:温度每升高10℃,反应速率增大为原来的______ 倍。
Ⅱ.为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验:
第①步:分别取1mL 1mol·L﹣1 KI溶液于两支试管中,并分别滴加两滴指示剂;
第②步:向其中一支试管中加入1mL蒸馏水和1mL 0.2mol·L-1 H2SO4溶液,同时在另一支试管中加入………………;
第③步:记录KI溶液变色的时间。
实验结论:溶液酸性越强,KI溶液变色越快。
回答下列问题:
(4)该探究实验中KI溶液变色反应的离子方程式为_________________ 。
(5)该实验操作中必须控制不变的是____________ 。
a.温度 b.试剂添加的顺序 c.试剂的用量(体积)
(6)用所给试剂将第②步补充完整。___________________________ 。
实验试剂:1mol·L-1 KI溶液、0.2mol·L-1 H2SO4溶液、蒸馏水
实验仪器:试管、试剂瓶、胶头滴管、温度计
I.针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该实验的目的是探究
(2)该实验除上述试剂和仪器外,还需要的仪器是
(3)分析上述实验记录结果,可得出的结论是:温度每升高10℃,反应速率增大为原来的
Ⅱ.为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验:
第①步:分别取1mL 1mol·L﹣1 KI溶液于两支试管中,并分别滴加两滴指示剂;
第②步:向其中一支试管中加入1mL蒸馏水和1mL 0.2mol·L-1 H2SO4溶液,同时在另一支试管中加入………………;
第③步:记录KI溶液变色的时间。
实验结论:溶液酸性越强,KI溶液变色越快。
回答下列问题:
(4)该探究实验中KI溶液变色反应的离子方程式为
(5)该实验操作中必须控制不变的是
a.温度 b.试剂添加的顺序 c.试剂的用量(体积)
(6)用所给试剂将第②步补充完整。
您最近一年使用:0次
2021-02-02更新
|
362次组卷
|
5卷引用:山东省青岛市黄岛区2020-2021学年高二上学期期中考试化学试题
7 . 工业上除去电石渣浆 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:

下列说法正确的是
 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:
下列说法正确的是

A. 、 、 在过程Ⅰ、Ⅱ中均起催化剂作用 在过程Ⅰ、Ⅱ中均起催化剂作用 |
B.过程Ⅰ中,反应的离子方程式为 |
C.将10L上清液中的 转化为 转化为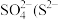 浓度为480 mg·L−1),理论上共需要0.03mol的 浓度为480 mg·L−1),理论上共需要0.03mol的 |
D.常温下,56gCaO溶于水配成1L溶液,溶液中 的数目为 的数目为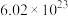 个 个 |
您最近一年使用:0次
2021-01-02更新
|
553次组卷
|
5卷引用:江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题
江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题安徽省示范高中皖北协作区2020年第22届高三联考理科综合化学(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)湖北省龙泉中学、宜昌一中2021届高三下学期2月联合考试化学试题黑龙江省大庆实验中学实验一部2020-2021学年高一下学期开学考试化学试题
名校
8 . 某化工厂生产硝酸的流程如图1所示,其他条件相同时,装置③中催化剂铂网的成分、温度与氧化率的关系如图2所示,下列说法错误的是
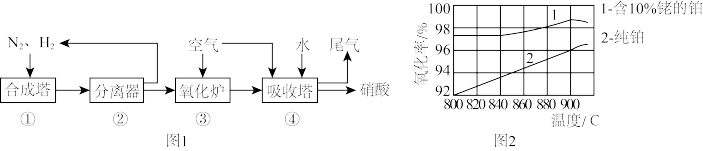

| A.该流程中,装置①③④中发生了氧化还原反应 |
B.装置②中利用氨气易液化的性质分离出 ,既加快了正反应速率又提高了合成氨的产率 ,既加快了正反应速率又提高了合成氨的产率 |
| C.装置③中最佳反应条件是铂网的成分为含10%铑的铂、温度为900℃ |
D.装置④中排出的废气含 、 、 等,可以用烧碱溶液吸收 等,可以用烧碱溶液吸收 |
您最近一年使用:0次
2020-12-19更新
|
411次组卷
|
4卷引用:湖北省荆州市2021届高三上学期第一次质量检查化学试题
湖北省荆州市2021届高三上学期第一次质量检查化学试题江西省景德镇市景德镇一中2022届高三10月月考化学试题(已下线)热点5 常见元素及其化合物的性质与应用-2021年高考化学专练【热点·重点·难点】山西省怀仁市2021-2022学年高二上学期期末调研化学试题
20-21高三上·江西南昌·期中
解题方法
9 . (1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应化学方程式为:C2H5OH(g)+IB(g)=ETBE(g)△H。反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=___ kJ/mol。反应历程的最优途径是____ (填C1、C2或C3)。
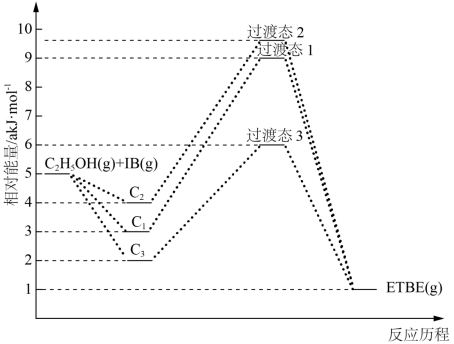
C1表示先吸附乙醇,C2表示先吸附异丁烯,C3表示乙醇和异丁烯同时吸附
(2)用NH3可消除NO污染,反应原理为:4NH3+6NO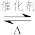 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。

①曲线a对应的n(NH3):n(NO)=___ 。
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为____ 。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是____ (至少写两条)。
(3)已知NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____ ;在上图标出点中,指出能表示反应达到平衡状态的点是___ ,理由是___ 。
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) 2SO3(g)。
2SO3(g)。
已知:标准平衡常数Kθ= ,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=
,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=____ (用含ω的最简式表示)。

C1表示先吸附乙醇,C2表示先吸附异丁烯,C3表示乙醇和异丁烯同时吸附
(2)用NH3可消除NO污染,反应原理为:4NH3+6NO
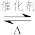 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。
①曲线a对应的n(NH3):n(NO)=
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是
(3)已知NO2存在如下平衡:2NO2(g)
 N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)
 2SO3(g)。
2SO3(g)。已知:标准平衡常数Kθ=
 ,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=
,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=
您最近一年使用:0次
10 . 乙烯是现代工业的重要原材料,研究工业制取乙烯有重要的意义。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)⇌C2H4(g)+H2O(g)+CO(g) △H1
Ⅱ.C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g) △H2=+430 kJ·mol-1
反应的能量变化图如图所示:

①C2H6(g)+2CO(g)+3H2(g)⇌ 2C2H4(g)+2H2O(g) △H=________ kJ·mol-1
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是________ ;一定温度和压强下,为了提高反应速率和乙烯的选择性,应当________ 。
③容器体积为1.0 L,控制C2H6和CO2初始投料量为2 mol和3 mol,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。

( )
)
则X代表______ (填“温度”或“压强”);L1和L2哪个大?并请说出理由:________ ;M点反应Ⅰ的平衡常数为________ (结果保留2位有效数字)。
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)⇌C2H4(g)+2H2(g) ΔH>0,温度T时,向2 L的恒容反应器中充入2 mol CH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:

实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为________ ;若将温度升高,速率常数增大的倍数:k正________ k逆(填“>”“=”或“<”)。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)⇌C2H4(g)+H2O(g)+CO(g) △H1
Ⅱ.C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g) △H2=+430 kJ·mol-1
反应的能量变化图如图所示:

①C2H6(g)+2CO(g)+3H2(g)⇌ 2C2H4(g)+2H2O(g) △H=
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是
③容器体积为1.0 L,控制C2H6和CO2初始投料量为2 mol和3 mol,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。

(
 )
)则X代表
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)⇌C2H4(g)+2H2(g) ΔH>0,温度T时,向2 L的恒容反应器中充入2 mol CH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:

实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为
您最近一年使用:0次



