名校
解题方法
1 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有___________ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是___________ ;判断“浸取”的最佳液固比为___________ 。
(3)常温时,几种金属离子沉淀的pH如图所示,加 时发生反应的离子方程式为
时发生反应的离子方程式为___________ ;“调pH(Ⅰ)”时,调节溶液 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为___________ (填化学式)。___________ 。
 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: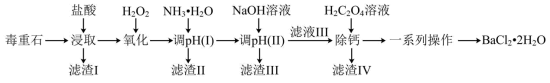
 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | 3:1 | 4:1 | 5:1 | 6:1 | |
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 |
(3)常温时,几种金属离子沉淀的pH如图所示,加
 时发生反应的离子方程式为
时发生反应的离子方程式为 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为
您最近一年使用:0次
解题方法
2 . 利用图中装置进行实验,能达到实验目的的是
| A | B |
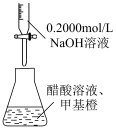 | 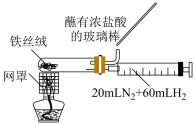 |
| 装置测定醋酸浓度 | 合成氨并检验氨的生成 |
| C | D |
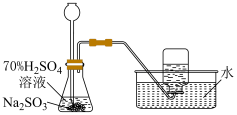 | 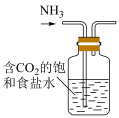 |
制备 | 模拟侯氏制碱法制备 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
23-24高三上·天津·阶段练习
名校
3 . 某温度下发生反应:3H2(g)+N2(g)⇌2NH3(g) ΔH=-92.4kJ/mol,N2的转化率(α)与体系总压强(p)的关系如图所示,下列说法中正确的是
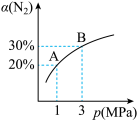

| A.将1molN2、3molH2置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| B.平衡状态由A变到B时,平衡常数KA<KB |
| C.上述反应在达到平衡后,增大压强,H2的转化率增大 |
| D.合成氨工业中常采用400~500℃的高温以提高原料的转化率 |
您最近一年使用:0次
名校
4 . 合成氨是人类科技发展史上的一项重大突破。
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24kJ的热量,写出该可逆反应的热化学方程式:___________ 。从平衡视角合成氨应该选择常温条件,但实际工业生产却选择500℃左右的高温,可能的原因是___________ 。
(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为___________ 。
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是___________ (写出一条)。
(4)如图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是___________ 。

A.图中a点,容器内n(N2):n(NH3)=1:4
B.图中b点,V正<V逆
C.400-530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升温化学反应速率加快
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24kJ的热量,写出该可逆反应的热化学方程式:
(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是
(4)如图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是

A.图中a点,容器内n(N2):n(NH3)=1:4
B.图中b点,V正<V逆
C.400-530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升温化学反应速率加快
您最近一年使用:0次
2023-12-04更新
|
42次组卷
|
2卷引用:江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题
解题方法
5 . 合成氨工艺是人工固氮最重要的途径。下图是合成氨的简要流程和反应方程式:
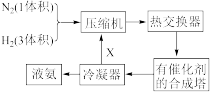


(1)图中X的主要成分是___________ ,这样操作的目的是___________ 。
(2)有利于提高合成氨平衡产率的条件为
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)T℃时,若在容积为 的密闭恒容容器中充入
的密闭恒容容器中充入 和
和 ,
, 后达到平衡,测得
后达到平衡,测得 的浓度为
的浓度为 。
。
①计算此段时间的反应速率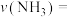
___________ , 的转化率为
的转化率为___________ 。
②已知300℃时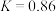 ,则(3)中的反应温度T
,则(3)中的反应温度T___________ 300(填“>”“<”或“=”)。
③若向平衡后的体系中同时加入 、
、 、
、 ,该反应是否处于平衡状态
,该反应是否处于平衡状态___________ (填“是”或“否”),此时
___________  。(填“>”或“<”或“=”)
。(填“>”或“<”或“=”)



(1)图中X的主要成分是
(2)有利于提高合成氨平衡产率的条件为
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)T℃时,若在容积为
 的密闭恒容容器中充入
的密闭恒容容器中充入 和
和 ,
, 后达到平衡,测得
后达到平衡,测得 的浓度为
的浓度为 。
。①计算此段时间的反应速率
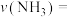
 的转化率为
的转化率为②已知300℃时
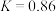 ,则(3)中的反应温度T
,则(3)中的反应温度T③若向平衡后的体系中同时加入
 、
、 、
、 ,该反应是否处于平衡状态
,该反应是否处于平衡状态
 。(填“>”或“<”或“=”)
。(填“>”或“<”或“=”)
您最近一年使用:0次
名校
解题方法
6 . 工业上用生物法处理 的原理如下:
的原理如下:
反应1:
反应2: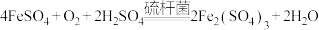
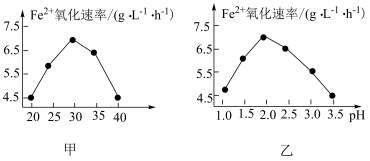
以硫杆菌作催化剂时,反应温度及溶液 对
对 氧化速率的影响分别如图甲、图乙所示。下列有关说法错误的是
氧化速率的影响分别如图甲、图乙所示。下列有关说法错误的是
 的原理如下:
的原理如下:反应1:

反应2:
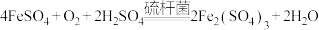
以硫杆菌作催化剂时,反应温度及溶液
 对
对 氧化速率的影响分别如图甲、图乙所示。下列有关说法错误的是
氧化速率的影响分别如图甲、图乙所示。下列有关说法错误的是
A.反应1的条件下,还原性: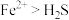 |
B.当反应温度过高时, 氧化速率下降的原因可能是硫杆菌失去活性 氧化速率下降的原因可能是硫杆菌失去活性 |
C.由图甲和图乙可得出结论:使用硫杆菌作催化剂的最佳条件为 、 、 |
D.当反应1中转移 电子时,反应1中消耗的 电子时,反应1中消耗的 在标准状况下的体积为 在标准状况下的体积为 |
您最近一年使用:0次
2023-11-09更新
|
117次组卷
|
2卷引用:江西省赣州市十八县23校2023-2024学年高二上学期期中联考化学试题
名校
7 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
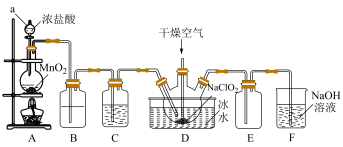
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
629次组卷
|
2卷引用:江西省广信中学2023-2024学年高一上学期11月月考化学试题
名校
8 . 如下图所示为工业合成氨的流程图。下列说法不正确的是
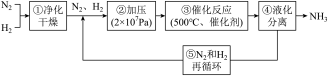

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③、④、⑤均有利于提高原料平衡的转化率 |
| D.为提高反应物的转化率应及时将氨从混合气中分离出去 |
您最近一年使用:0次
2023-10-26更新
|
327次组卷
|
7卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
9 . 工业生产无铁硫酸铝,以硫酸浸取铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)得含铁(Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,二氧化锰和Fe(OH)3发生吸附共沉作用,最终得到无铁硫酸铝产品。
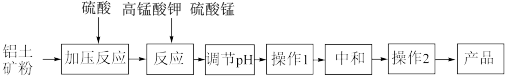
(1)硫酸浸取铝土矿时主要反应的离子方程式为___________ 。
(2)完成高锰酸钾溶液和硫酸锰溶液反应的化学方程式:KMnO4+MnSO4+H2O=___________ 。
(3)调节pH的作用是___________ 。
(4)操作1的名称为___________ ,实验室进行操作2用到的陶瓷质 仪器有___________ 。
(5)下列有关工艺的说法正确的是___________(填字母)。
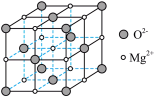
(6)氧化镁熔沸点高,可制造耐火、耐高温器材,其晶胞结构如图所示。该晶体中每个 周围与它最近且距离相等的
周围与它最近且距离相等的 数为
数为___________ ;若该立方晶胞参数为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
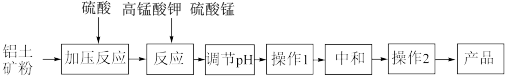
(1)硫酸浸取铝土矿时主要反应的离子方程式为
(2)完成高锰酸钾溶液和硫酸锰溶液反应的化学方程式:KMnO4+MnSO4+H2O=
(3)调节pH的作用是
(4)操作1的名称为
(5)下列有关工艺的说法正确的是___________(填字母)。
| A.可以向溶液中再加入铝土矿粉等调节pH |
| B.溶液的碱性越强,则除铁效果越好,而且不会影响硫酸铝的产率 |
| C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本 |
| D.可以直接向溶液中加入二氧化锰粉末以除去Fe(OH)3 |
(6)氧化镁熔沸点高,可制造耐火、耐高温器材,其晶胞结构如图所示。该晶体中每个
 周围与它最近且距离相等的
周围与它最近且距离相等的 数为
数为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
10 . 下列关于工业合成氨的叙述错误的是
| A.反应在高压下进行,有利于提高转化率 |
| B.温度越高越有利于工业合成氨 |
| C.在工业合成氨中,N2、H2的循环利用可降低成本 |
| D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动 |
您最近一年使用:0次



